Non-IgE allergia
Szerző: Dr. Krkos Károly
Az étel-érzékenységeket két nagy csoportba szokás sorolni: az immunrendszer közreműködése nélkül gyomor-bélrendszeri és egyéb tüneteket okozó állapotokba (intoleranciák) és az immunrendszer részvételével járó kórfolyamatokba (immun-mediálta ételérzékenységek). Az előbbiek hátterében felszívódási zavarok, enzimdefektusok, toxikus szennyeződés okozta állapotok, farmakológiai hatások állnak2. Az immun-mediált ételérzékenységek jelentős részében IgE típusú ellenanyagoké a döntő szerep (klasszikus allergia, I. típusú hiperszenzitivitás). Léteznek viszont olyan kórállapotok, melyekben nem az IgE termelődés – hízósejt aktiváció játssza a döntő szerepet, hanem az IgE képződés mellett vagy anélkül más mechanizmusok járulnak hozzá a patogenezishez („kevert IgE/non-IgE”, „non-IgE allergia”). Az ún. non-IgE allergiák sem IgE- sem IgG- termelődéssel nem jellemezhetőek. Az előbbiektől eltérnek a III. típusú hiperszenzitivitással járó folyamatok (IgG-közvetítette ételérzékenységek). Külön kategóriát jelentenek a pszeudoallergiák, melyek alapja a hízósejt nem IgE-FceRI úton történő aktiválódása (komplement aktivációval kapcsolatos pszeudoallergia – CARPA, egyéb receptorokon keresztül történő közvetlen aktiválódás, leukotriénszintézis túlsúly COX-gátlás miatt).
- ábra: Az ételérzékenységek osztályozása
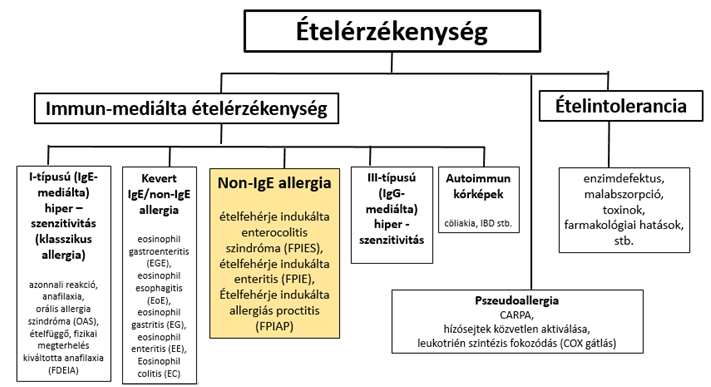
A kevert IgE/non-IgE és non-IgE allergiák diagnosztizálásában elsődleges szerepet a pontos, részletes anamnézis, a kórlefolyás alapos megismerése játssza, melyet sok esetben képalkotó eljárásokkal, endoszkópos módszerekkel, biopsziás minták vizsgálatával szükséges kiegészíteni.
A non-IgE mediált gasztrointesztinális ételallergia (non-IgE-GI-FA) betegségek közé sorolható három fő kórkép: az étel-fehérje indukálta enterokolitisz szindróma (FPIES), az ételfehérje indukálta enteropátia (FPE); és az ételfehérje indukálta allergiás proktokolitisz (FPIAP)1,13,15. Emellett ide tartozik két nagyon ritka állapot: a Heiner szindróma (pulmonáris hemosziderózis)13,20-23 és a tehéntej indukálta vashiányos anémia (cow’s milk protein allergy-related iron deficiency anemia, CMPA-IDA)13,24,25.
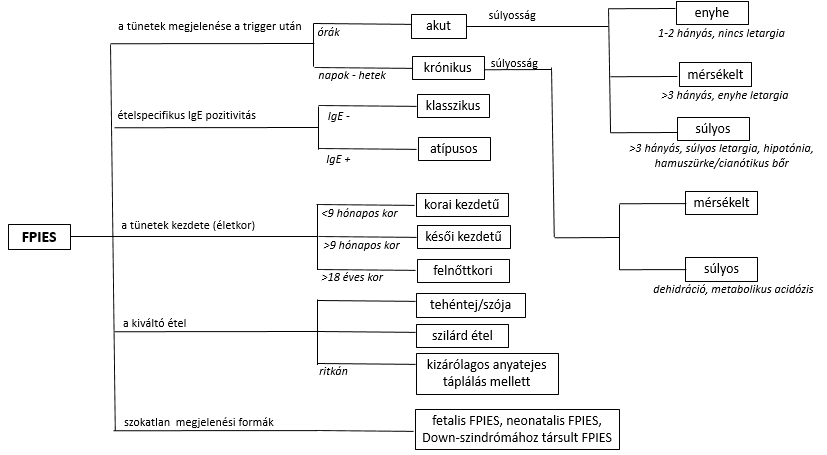
Míg a klasszikus, IgE-mediált ételallergia (IgE-FA) esetén a tünetek az ételfogyasztást követően röviddel (1-2 perc-1 óra) megjelennek és azok nemcsak a gyomor-bélrendszerre korlátozódnak (bőr, nyálkahártyák esetleg légzés és keringés is érintett, anafilaxia alakulhat ki), addig a non-IgE-GI-FA csoportba tartozó állapotokban a tünetek később jelentkeznek (2-3 óra múlva), s kizárólag az emésztő szervrendszerre korlátozódnak1,13,15. Tipikusan nem mutatható ki étel-specifikus IgE ellenanyag (az FPIES egy kisebb hányadát leszámítva)1,13-19. A pontos patomechanizmus nem ismert. A non-IgE-GI-FA betegségek kontinuumot képeznek. A tünetek kifejeződése és súlyossága attól függ, hogy a gyomorbélrendszer mely szakasza(i) érintett(ek): az FPIAP esetén, amikor a folyamat a distalis vastagbélszakaszra korlátozódik, friss vér ürül a végbélből (hematochezia) az egyébként egészségesnek tűnő csecsemőknél. A vékonybél érintettséggel járó FPE esetén a felszívódási zavar (malabszorpció) és a fejlődéselmaradás (failure to thrive – FTT) uralja a klinikai képet. A legsúlyosabb, gyakran akut, ijesztő tüneteket produkáló FPIES a teljes gyomor-bélrendszer érintettségére utal. Legfőbb jellemzője a csillapíthatatlan hányás, súlyosabb esetben metabolikus rendellenességek és hipovolémiás sokk. Az FPIES tovább osztályozható a tünetek megjelenésének időpontja (akut és krónikus), súlyossága (enyhe, mérsékelt, súlyos), a páciens életkora (korai kezdetű, késői kezdetű, felnőttkori), a kiváltó étel fajtája (tehéntej/szója vagy szilárd étel okozta) szerint. A páciensek egy részében ételspecifikus IgE antitest is kimutatható („atipusos FPIES”- 2. ábra).
- ábra: az FPIES osztályozása ( L Labrosse, F Graham and J-C Caubet: Non-IgE-Mediated Gastrointestinal Food Allergies in Children: An Update alapján)
A non-IgE-GI-FA betegségek előfordulási gyakorisága csak kevéssé tanulmányozott, a leggyakoribb kórképnek az FPIAP-t tartják. A végbélvérzés panasszal vizsgált csecsemők 60%-a bizonyul FPIAP-nek. A legkevésbé az FPE prevalenciája ismert, annyi azonban bizonyos, hogy incidenciája csökkenő tendenciát mutat, feltehetőleg az anyatejes táplálás népszerűbbé válása és a jobb minőségű anyatejpótló formulák miatt. Az FPIES ritka betegség, felmérések alapján incidenciáját 0,3-0,7%-nak tartják. A betegségcsoport gyakran társul valamilyen atópiás állapottal (FPIES esetén a páciensek 40-60%-a érintett, FPE és FPIAP betegeknél ez 40-50%), ill. a családtagok 60-80%-a atópiás.
Az atópia26-28genetikai hajlammal összefüggő fogékonyság allergiás betegségekre: allergiás asztmára, dermatitiszre, rinitiszre (szénanáthára), ételallergiára. A betegségcsoportra jellemző az ún. atópiás menet (atopic marsh): a kezdeti atópiás dermatitiszt (és ételallergiát) allergiás asztma és rinitisz váltja fel. A dermatitisz – asztma – rinitisz hármast atópiás triádnak is nevezik.
A Heiner-szindróma20-23 egy tehéntej fehérje indukálta atípusos tüdőbetegség csecsemőkben és kisgyermekekben. Visszatérő légúti tünetek, a mellkasröntgenen tüdőgyulladást imitáló infiltrátumok, láz, anémia, fejlődéselmaradás jellemzik. Néhány gyermeknél az előbb felsoroltakon kívül gyomor-bélrendszeri tünetek (hányás, hasmenés, hasi fájdalom, véres széklet) is megjelennek. Kórtani háttere nem tisztázott, de feltételezik, hogy III. típusú érzékenység (immunkomplex képződés) áll a hátterében. A tünetek a tehéntejet tartalmazó étrend megkezdését követő 1-9 hónap múlva jelennek meg. Az esetek mintegy 10%-ban a megbetegedés súlyos lefolyású, pulmonáris hemosziderózishoz vezet. Alkalmanként máj, lép és nyirokcsomó megnagyobbodás is észlelhető. Előfordult, hogy a kifejezett gyomor-bélrendszeri tünetek mellett a hematochezia (vérürítés a végbélen keresztül) uralta a klinikai képet21. A hörgő- és gyomor-aspirátumban hemosziderin tartalmú makrofágok láthatók. Sok esetben tejfehérje ellen termelődött IgG pozitivitás mutatható ki. Az IgE az esetek nagy részében negatív, de pozitivitás is előfordulhat. A tejtermékek elhagyását követő 5- 21 nap elteltével a tünetek megszűnnek. A betegség súlyos állapotában alveoláris hipoventillációhoz, masszív akut pulmonáris hemosziderózishoz, pulmonáris hipertenzióhoz és cor pulmonaléhoz vezethet, emiatt fontos a kórkép mielőbbi felismerése és a tehéntej eliminálása az étrendből.
A csecsemő- és kisgyermekkori vérszegénység leggyakoribb oka a vashiány (prevalenciáját 1-3 éves kor között 0,9-4,4%-ra becsülik). Ennek fő oka a nem megfelelő vasbevitel. Az esetek kis százalékában viszont a tehéntej érzékenység miatti fokozott vesztés a vashiány oka: ez a tehéntej allergiához köthető vashiányos anémia (cow’s milk allergy-related iron deficiency anemia, CMA-IDA)24,25. Tünetei: sápadtság (100%), hipoalbuminémia (86%), okkult vérzés a székletben (57%), általános ödéma (43%), fejlődéselmaradás (43%). A páciensek 4/5-e pozitivitást mutat tehéntej ellen termelődött IgE-re. A kolonoszkópia során erozív hemorrágiás kolitisz és limfoid hiperplázia látható, eozinofilia viszont nem. A tej elhagyásával és vaspótlással az állapot megszűnik.
A non-IgE-GI-FA kórtani háttere kevéssé feltárt1,3,16. Elsősorban a nem megfelelő sejtes immunválaszt tartják a betegség fő okának. FPIES-ben az ételantigén-specifikus T-sejtek fokozott TNF szekréciójáról és a csökkent TGF elválasztásról írnak a közlemények. A lokális T-sejt infiltráció és gyulladás a bél-permeabilitás fokozódásához, az antigének könnyebb beáramlásához vezet. Az IL-4, IL5, IL-9, IL-13 termeléssel járó, túlsúlyba került Th2 válasz összefügg az atópiás hajlammal. Orális ételterhelés (oral food challenge – OFC) során a veleszületett (innate) immunrendszer sejtjei (monociták, neutrofilok, eozinofilok és NK sejtek) aktiválódnak. Az IL-9 termelődés hízósejt toborzást és intesztinális anafilaxiát eredményez. Az alap triptáz szint magasabb OFC pozitív egyénekben – ami azt mutatja, hogy a hízósejtek is jelentős szerephez jutnak a folyamatban. A humorális immunitást vizsgálva, alacsony szintű neutralizáló, specifikus IgG4 antitesteket találtak.
FPE esetén a jejunalis mucosa (éhbél nyálkahártya) szerkezetének károsodását észlelték, ételspecifikus (főként tehéntej specifikus) T-sejt infiltrációval, mely malabszorpcióhoz vezet. A betegség kialakulásában a citotoxikus (CD8+) T sejtek aktiválódásának vezető szerepet tulajdonítanak. Az felszívóhám sejtek közötti a ϒδ-TCR+ sejtek nagy mennyiségét is megfigyelték.
Az FPIAP fő kórtani jellegzetessége a végbél-szigmabél nyálkahártya eozinofil sejtes infiltrációja. Ez az állapot elsősorban anyatejes táplálásban részesülő csecsemőkben alakul ki, így feltételezik, hogy az anyatejben lévő immunreakciót kiváltó komponenseknek lehet szerepük a betegség kialakulásában.
Klinikai tényezők alapján az alábbi (1.) táblázat mutatja a 3 tünetcsoport (és az FPIES alcsoportok) jellegzetességeit (1. L Labrosse, F Graham and J-C Caubet: Non-IgE-Mediated Gastrointestinal Food Allergies in Children: An Update alapján; rövidítések: A=akut, C=krónikus, OFC= orális étel terhelés):
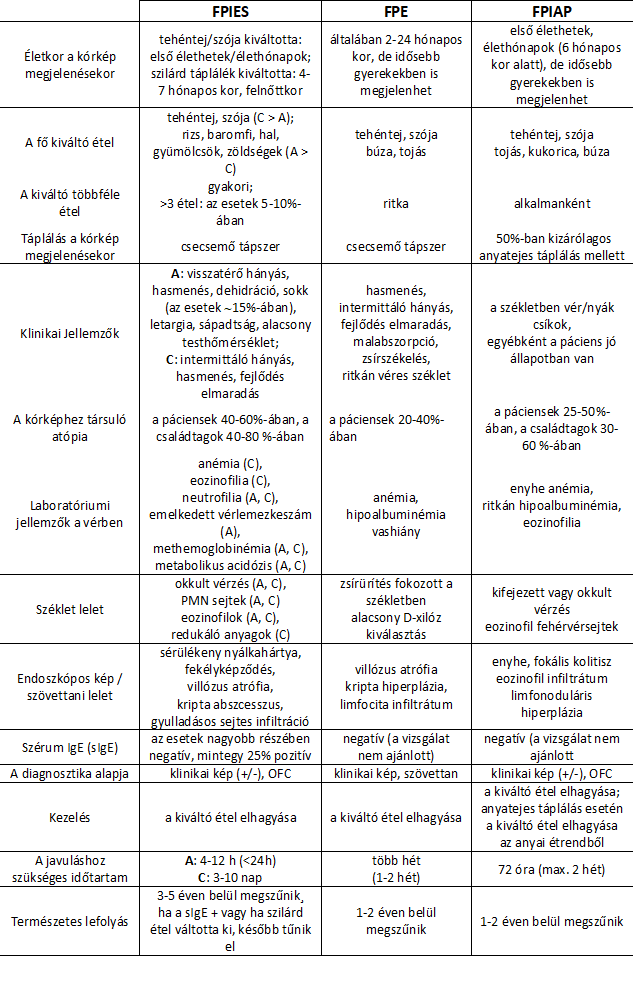
A= akut; C= krónikus; PMN sejtek= polimorfonukleáris sejtek
Az akut FPIES1,13-15,17 vezető tünete az evést követő 1-4 óra múlva megjelenő ismétlődő hányás (az esetek több, mint 95%-ában). Hasmenés az ételfogyasztás után 5-10 óra múlva jelenik meg, kisebb arányban (a páciensek 25-50%-ában). Az újszülöttekben szepszisre emlékeztető tünetek: letargia (65-100%), sápadtság (30-90%), hipotermia (5%) is megfigyelhetők7 . A klinikai kép súlyos is lehet: 15%-ban hemodinamikai instabilitás alakul ki.
A krónikus FPIES-t1,13-15,17 idült (néha nyákos és véres) hasmenés jellemzi, melyhez intermittáló hányás, hasfeszülés, testsúlygyarapodás elmaradás társul. A páciensek egy csoportjában a tünetek fokozatos rosszabbodása dehidrációhoz (15-45%), metabolikus zavarokhoz (5%) vezet29-31. Míg a krónikus FPIES esetén tehéntej vagy szója a kiváltó étel, addig az akut formát szilárd étel (leggyakrabban rizs) bevezetése provokálja gyakrabban. Az FPIES csak kis százalékban (0-5%) fordul elő kizárólagos anyatejes táplálás mellett. Az utóbbi években leírták a felnőttkori FPIES-t is, melyet legtöbbször tenger gyümölcsei váltanak ki3. A betegség újszülöttkorban jelentkező formáját is megismerték, melynek hátterében méhen belüli érzékenyítődés áll4.
Az FPE1,13,15 tünetei a cöliákiára emlékeztetnek, a legtöbb esetben csecsemőkorban, a tehéntej bevezetésekor jelentkeznek, ezek: krónikus hasmenés, malabszorpció, zsírszékelés, fejlődéselmaradás (failure to thrive – FTT), melyek a tehéntej elhagyására javulnak. Hányás is megjelenhet. A cöliákiában előforduló emésztőrendszeren kívüli problémák (pl. dermatitis herpetiformis) nem észlelhetők. A nyálkahártyakárosodás miatt másodlagos szénhidrát-intolerancia is kialakul5.
Az FPIAP – eltérően az előbb említett kórképektől – sok esetben kizárólagos anyatejes táplálás mellett fordul elő. Ezt az anyai étrendből az anyatejbe kerülő antigénekkel magyarázzák32. Fő tünete a véres, esetleg nyákos, laza székletürítés. Egyébként a csecsemő egészséges, sem erőteljes hányás, sem hasmenés, sem fejlődéselmaradás nem észlelhető. A páciensek egy részénél étel visszautasítás, irritábilitás is megfigyelhető. Bár tipikusan csecsemőkorban lehet találkozni a betegséggel, de nagyobb gyerekeknél is előfordulhat (18%-ban)33.
A non-IgE-GI-FA-t kiváltó ételek között első helyen a tehéntej áll (az esetek 40-50%-ában, FPIES gyermekek 65%-ában13), azonban számos más étel is kiválthatja – ezek kórképek szerint, országonként (és étkezési szokásonként valamint az eltérő genetikai háttér miatt) változók. Az FPIES fő provokáló étele a tehéntej mellett a szója. Sok esetben nemcsak egy komponens fogyasztása váltja ki a tüneteket, hanem 2 (az esetek 25%-ában13), 3 esetleg még több (főként szilárd kiváltó esetén – az esetek kevesebb, mint egytizedében13). Szilárd ételek között gabonafélék (rizs, zab), zöldségek között az édesburgonya és a tök, gyümölcsök között a banán, az avokádó, továbbá a baromfihús és tojás szerepelnek kiváltó tényezőként. Az Egyesült Államokban és Ausztráliában a rizs a leggyakoribb bűnös, súlyosabb tüneteket okoz7. Olaszországban és Spanyolországban a hal és a tenger gyümölcsei foglalják el az első helyet. Az FPE provokálói között szintén a tehéntej vezet esetleg szójával együtt, ezt követi a búza és kisebb arányban a banán, a tojás és a húsok. Végül az FPIAP-t a tehéntej (és egyéb ételek – az anyatejen keresztül, ritkábban közvetlenül) érzékenység jellemzi. (Egyéb ételek: szója, tojás, búza és kukorica.)
A non-IgE-GI-FA diagnosztizálásában a klinikai tünetek alapos elemzése és a kórházi felügyelet mellett végzett ételterhelés (oral food challenge – OFC) játssza a vezető szerepet, kivéve az FPE-t, melynek igazolásához rendszerint szövettani vizsgálat is szükséges1,1,13-15-17,18.
A kórismézés alapjait a (2.) táblázat foglalja össze (1. L Labrosse, F Graham and J-C Caubet: Non-IgE-Mediated Gastrointestinal Food Allergies in Children: An Update alapján):

*: Mindkét fő kirtériumnnak és legalább 3 minor kritériumnak kell teljesülni a diagnózishoz **:Kevés adat miatti általános kritériumok (nemzetközi konszenzus alapján) ***:Nincs definiált kritériumrendszer, a klinikai gyakorlat alapján használt jellemzők (FPIAP: EEACI állásfoglalás alapján34)
Az OFC orális ételterhelés) gold standard az FPIES diagnosztizálására és segít a differenciál diagnózisban. Az eljárás rizikója magas, így csak kórházi felügyelet mellett végezhető (intravénás folyadékpótlása, metabolikus zavar helyreállítása az esetek mintegy felében szükségessé válik). A fél óra hosszat tartó terhelés során a kiváltó ételt 3 egyenlő dózisban kapja a páciens. Ezt követően legalább 4-6 órás megfigyelés szükséges. Biztonságossági okokból tanácsos specifikus IgE vizsgálat végzése a terhelés előtt, a klasszikus allergia lehetőségének kizárására.
Az FPIES csoportban a páciensek negyedében előfordul szérum specifikus IgE pozitivitás (aspecifikus FPIES) – a többi kórformában nem javasolt IgE mérés. A laboratóriumi adatok nem specifikusak: anémia, hipoalbuminémia, emelkedett vérlemezkeszám (sokszor alacsony átlagtérfogattal – MPV-vel7), magasabb fehérvérsejt szám, nagyobb arányú fiatalabb alakkal, súlyosabb esetben metabolikus acidózis és methemoglobinémia is kialakulhat. Jellemzően a CRP nem vagy csak minimálisan emelkedett. Jelentős CRP emelkedés (>200mg/l) inkább kizárja a kórképet, ilyenkor alternatív diagnózisra kell gondolni7. FPE-re jellemző, hogy vashiányos anémia, hipoproteinémia alakul ki, ugyanakkor az FPIAP ritkán jár szérumeltéréssel. A székletben neutrofil és eozinofil leukociták, Charcot-Leyden kristályok, redukáló anyagok jelenthetnek meg35. FPIES és FPIAP esetén alkalmanként okkult vérzés, fokozott calprotectin ürítés mutatható ki.
Képalkotó eljárások nem számítanak az alapdiagnosztikai eljárások közé ebben a betegségcsoportban. A röntgenvizsgálat során néha bélfalon belüli gázképződés látható, ami nekrotizáló enterokolitisz képét utánozhatja. Ultrahang vizsgálat végzésekor vékonybélfal vastagodás, lassult perisztaltika észlelhető, ami a kiváltó étel megvonását követően eltűnik.
Endoszkópos vizsgálatok az FPE diagnosztizálásához szükségesek, biopsziás minta vételéhez. A cöliákiánál láthatóhoz képest enyhébb, jejunalis villózus atrófia és kripta hiperplázia figyelhető meg. A bélboholy/kripta arány az éhbél nyálkahártya károsodásának érzékeny mutatója6. Az FPIAP vizsgálatakor szembetűnő a nyálkahártya vérbősége, apró bevérzésekkel. A gyulladáshoz eozinofil sejtes infiltráció, limfonoduláris hiperplázia, hízósejt szaporulat társul35.
Az egyéb kórképek kizárásához (differenciál diagnosztikához) szükséges adatokat az alábbi (3.) táblázat foglalja össze:
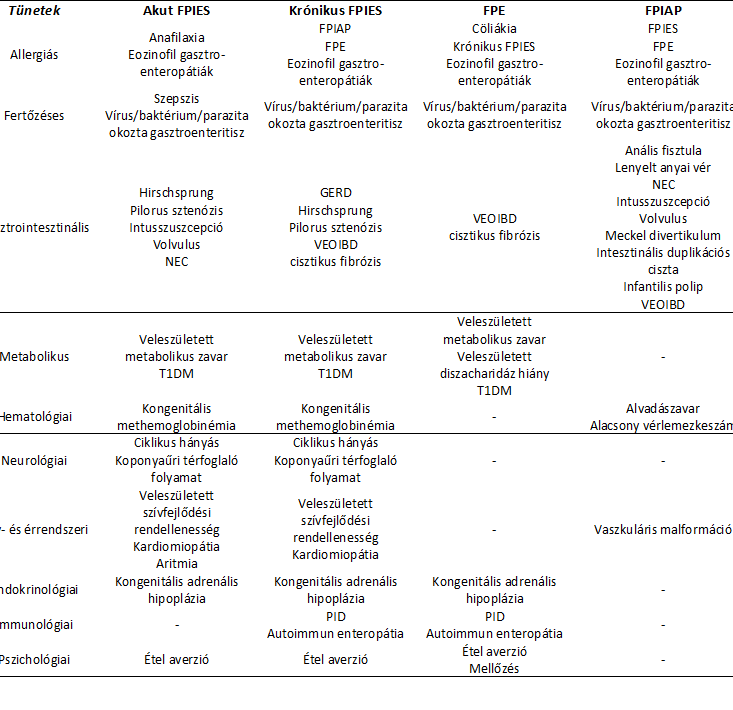
GERD: gasztroözofageális reflux betegség; NEC: nekrotizáló enterokolitisz, PID: primer immunodeficiencia; T1DM: 1. típusú diabétesz; VEOIBD: nagyon korai kezdetű gyulladásos bélbetegség (very early onset inflammatory bowel disease)
A non-IgE-GI-FA természetes lefolyása az esetek zömében kedvező. A csecsemőkori esetekben a többség iskoláskorra kinövi a betegséget. Az FPIES általában 3-5 éves kor előtt megoldódik, de a későbbi kezdetű és az atipusos FPIES lefolyása elhúzódóbb. Ráadásul utóbbi állapot azonnali típusú, IgE közvetítette reakcióba (klasszikus allergia) mehet át8, továbbá az ellenkezője is előfordulhat: az IgE-mediálta ételallergiát non-IgE-GI-FA válthatja fel9,10. Az FPE tipikusan 1-2 éven belül megoldódik (ellentétben a rá emlékeztető cöliákiával), de ritkán késői gyermekkorban is megmaradhat11. Az FPIAP gyakran 11 hónapos korra megszűnik, ritkán 1-2 éves korig fennmaradhat. FPIAP-n átesett betegek között gyakrabban alakulhat ki később funkcionális gyomor-bélrendszeri betegség, főként azoknál, akiknél a FPIAP súlyosabb és elhúzódóbb volt12.
A kezelésben1,13,18 a kiváltó étel eliminálása kulcsszerepet játszik. A cél, hogy feleslegesen ne hagyjunk el ételt, ill. ha bármilyen étrendmódosítás történik, azt mindenképpen dietetikus felügyelete mellett végezzük, hogy a hiánybetegségek elkerülhetők legyenek (különösen figyelni kell a megfelelő D-vitamin, kalcium, cink, szelén ellátásra). Az étel eliminációnak kétféle megközelítését alkalmazzák: az „alaptól felfelé” vagy a fentről lefelé” módszer. Enyhébb esetben az előbbihez folyamodnak: először a legvalószínűbb ételt (pl. tehéntej) elhagyását javasolják. Ha ez nem elegendő, további étellel próbálkoznak, egymást követően. Súlyos esetben elementáris diétát állítanak be (aminosavakat tartalmaz), mely mellőzi az allergéneket, majd javulást követően fokozatosan, egymást követően próbálkoznak különböző ételek bevezetésével.
A tehéntejmentes étel indikálásakor vagy fokozottan hidrolizált formula (extensively hydrolyzed formula – EHF) vagy aminosav alapú formula (amino acid-based formula, AAF) javasolt. Az FPIES betegek súlyos állapotba kerülhetnek, ilyenkor sürgősségi ellátást igényelnek, a só-víz háztartás és a metabolikus egyensúly zavarának rendezésére. Epinefrin (adrenalin) adása csak IgE pozitív FPIES (atipusos FPIES) során válhat szükségessé. Mivel az FPIAP esetek jelentős része anyatejes táplálás mellett fordul elő, az anya étrendjéből szükséges mellőzni a tehéntej- és szója-termékeket.
Mivel a betegség az esetek túlnyomó többségében pár éven belül megszűnik, az esetleges gyógyult állapotot 12-18 hónaponként kórházban végzett OFC teszttel ellenőrzik. Az FPIES megelőzésére a kevésbé allergén ételek bevezetését javasolják az elválasztás során: a zöldségek közül a brokkolit, karfiolt, fehérrépát, tököt, gyümölcsök közül a feketeáfonyát tanácsolják. Fontosnak tartják a különböző színű, ízű, textúrájú ételek fokozatos egymás utáni bevezetését.
Irodalom
- L Labrosse, F Graham and J-C Caubet: Non-IgE-Mediated Gastrointestinal Food Allergies in Children: An Update 2020, Nutrients, 12:2086, doi:10.3390/nu12072086
- S Waserman, P Bégin and W Watson: IgE-mediated food allergy 2018, Allergy, Asthma & Clinical Immunology 14(Suppl. 2):55, https://doi.org/10.1186/s13223-018-0284-3
- S Ichimura, H Kakita et al: A Rare Case of Fetal Onset, Food Protein-Induced Enterocolitis Syndrome 2019, Neonatology, DOI: 10.1159/000502717
- M R Faber, P Rieu et al: Allergic colitis presenting within the first hours of premature life 2005, Clinical Observations, DOI: 10.1080/08035250510039892
- N Iyngkaran, Z Abdin et al: Acquired carbohydrate intolerance and cow milk protein-sensitive enteropathy in young infants 1979, The Journal of Pediatrics, 95(3):373-378
- R McCalla, E Savilahti et al: Morphology of the Jejunum in Children with Eczema due to Food Allergy 1980, Allergy, 35:563-571
- E Lee, R H Barnes et al: Differentiating Acute Food Protein–Induced Enterocolitis Syndrome From Its Mimics: A Comparison of Clinical Features and Routine Laboratory Biomarkers 2019 J Allergy Clin Immunol Pract, https://doi.org/10.1016/j.jaip.2018.10.020
- A Kessel, I Dalal: The pendulum between food protein–induced enterocolitis syndrome and IgE-mediated milk allergy 2011, Acta Paediatrica, 100:e183-e185, DOI:10.1111/j.1651-2227.2011.02257.x
- C Banzato, G L Piacentini et al: Unusual shift from IgE-mediated milk allergy to food protein-induced enterocolitis syndrome 2013, Eur Ann Allergy Clin Immunol, 45(6):209-211
- H Duffy, M Egan: Development of food protein–induced enterocolitis syndrome (FPIES) to egg after immunoglobulin E–mediated egg allergy 2018, Annals of Allergy, Asthma, Immunology, doi: 1016/j.anai.2018.05.028
- W A Walker: Cow’s milk protein-sensitive enteropathy at school age: a new entity or a spectrum of mucosal immune responses with age 2001, The Journal of Pediatrics, 139:765-766
- G Di Nardo, C Cremon et al: Allergic Proctocolitis Is a Risk Factor for Functional Gastrointestinal Disorders in Children 2018, The Journal of Pediatrics, 195:128-133, DOI: 10.1016/j.peds.2017.10.073
- L Connors, A O’Keefe et al: Non-IgE-mediated food hypersensitivity 2018, Allergy, Asthma & Clinical Immunology, 14(Suppl. 2):56, https://doi.org/10.1186/s13223-018-0285-2
- K M Järvinen, A Novak-Węgrzyn: Food Protein-Induced Enterocolitis Syndrome (FPIES): Current Management Strategies and Review of the Literature 2013, J Allergy Clin Immunol In Practice, 1(4):317-322, http://dx.doi.org/10.1016/j.jaip.2013.04.004
- E Feuille, A Novak-Węgrzyn: Food Protein-Induced Enterocolitis Syndrome, Allergic Preoctocolitis, Enteropathy 2015, Curr Allergy Asthma Rep, 15:50, DOI 10.1007/s11882-015-0546-9
- M C Berin: Immunopathophysiology of food protein–induced enterocolitis syndrome 2015, Journal of Allergy and Clincal Immunology, 135:1108-1113, http://dx.doi.org/10.1016/j.jaci.2014.12.1948
- S M Sopo, M Greco et al: Food-Protein Indueced Enterocolotis Syndrome – from Practice to Theory 2013, Export Rev Clinical Immunol., 9(8):707-715, doi: 10.1586/1744666X.2013.814418
- A Novak-Węgrzyn, M Chehade et al: International consensus guidelines for the diagnosis and management of food-protein induced enterocolitis syndrome: Executive summary – Workgroup report of the Adverse Reactions to Food Committee, American Academy of Allergy, Asthma & Immunology 2017, Journal of Allergy and Clinical Immunology, 139:1111-1126, http://dx.doi.org/10.1016/j.jaci.2016.12.966
- A Nocerino: Protein Intolerance 2017, emedicine/Medscape, https://emedicine.medscape.com/article/931548-print
- A J Ojuawo, O B Ojuawo et al: Heiner Syndrome: An uncommon cause of failure to thrive, Malawi Medical Journal, 31(3):227-229, https://dx.doi.org/10.4314/mmj.v31i3.11
- Xiang-Yu Liu, Xi-Ru Huang et al: Hematochezia in a Child With Heiner Syndrome 2020, Frontiers in Pediatrics, 7:Article 551, doi: 10.3389/fped.2019.00551
- S Arasi, C Mastroilli et al: Heiner Syndrome and Milk Hypersensitivity: An Updated Overview on the Current Evidence 2021, Nutrients, 13:1710, https://doi.org/10.3390/nu13051710
- A S Koc, A Sucu, U Celik: 23 A different clinical presentation of Heiner syndrome: The case of diffuse alveolar hemorrhage causing massive hemoptysis and hematemesis 2019, Respiratory Medicine Case Reports, 26:206-208, https://doi.org/10.1016/j.rmcr.2019.01.019
- Fu-Ping Lai, Yao-Jong Yang: The prevalence and characteristics of cow’s milk protein allergy in infants and young children with iron deficiency anemia 2017, Pediatrics and Neonatology, 59:48-52, http://dx.doi.org/10.1016/j.pedneo.2017.01.004
- K Graczykowska, J Kaczmarek et al: The Consequence of Excessive Consumption of Cow’s Milk: Protein-Losing Enteropathy with Anasarca in the Course of Iron Deficiency Anemia – Case Reports and Literature Review 2021, Nutrients, 13:828, https://doi.org/10.3390/nu13030828
- H Han, F Roan, S F Ziegler: The atopic marsh: current insight into skin barrier dysfunction and epithelial cell-dewrived cytokines 2017, Immunology Reviews, 278(1):116130; doi: 1111/imr.12546.
- M S Gold, A S Kemp: Atopic Disease in Childhood 2005, Medical Journal of Australia, 182(6):298-304, doi: 10.5694/j.1326-5377.2005.tb06707.x
- D Verschoor, S von Gunten: Allergy and Atopic Diseases: An Uptake and Experimental Evidence 2019, International Archives of Allergy and Immunology, 180:235-243, DOI: 10.1159/000504439
- Kuan-Wen Su, Sarita Patil et al: Food aversion and poor weight gain in food protein-indiced enterocolitis syndrome: A retrospective study 2020, Journal of Allergy and Clinical Immunology, 145:AB52, doi: 10.1016/j.jaci.2019.12.687
- J C Caubet, L S Ford et al: Clinical features and resolution of food protein–induced enterocolitis syndrome: 10-year experience 2014, Journal of Allergy and Clinical Immunology, 134(2):382-389, doi: 10.1016/j.jaci.2014.04.008
- C Delahaye, A Chauveau et al: Food protein-induced enterocolitis syndrome (FPIES) in 14 children 2017, Archives de Pédiatrie, 24(4):310-316, doi: 1016/j.arcped.2017.01.011
- A C Lozinsky, M B de Morais: Eosinophilic colitis in infants 2014, Jornal de Pediatria, 90(1):16-21, doi:1016/j.jped.2013.03.024
- A Ravelli, V Villanacci Dietary Protein-Induced Proctocolitis in Childhood 2008, American Journal of Gastroenterology, 103(10):2605-2612, doi: 1111/j.1572-0241.2008.02035.x
- R Meyer, A C Lozinsky et al: Diagnosis and management of non-IgE gastrointestinal allergies in breastfed infants – An EEACI Position Paper 2019, Allergy, 75:14-32, DOI: 10.1111/all.13947
- A Nowak-Wegrzyn, M Chehade et al: International consensus guideline for the diagnosis and management of food
protein-induced enterocolitis syndrome: Executive summary-Workgroup Report of the Adverse Reactions to
Foods Committee, American Academy of Allergy, Asthma & Immunology 2017, Journal of Allergy and Clinical Immunology, 139:1111e4-1126e4, doi: 10.1016/j.jaci.2016.12.966



