Szerző: Dr. Krkos Károly
Irritábilis bél szindróma (IBS)
Az irritábilis bél szindróma (IBS) a gyomor-bélrendszer funkcionális rendellenessége, melynek fő jellegzetessége a hasi fájdalom és a megváltozott bélhabitus¹–³ (hosszantartó hasmenés vagy székrekedés vagy a kettő váltakozása vagy normális szakaszokat követően hasmenés és/vagy székrekedés³). Organikus eltérés általában nem mutatható ki, leszámítva azt a néhány pácienst, akiknél mikroszkópos gyulladás észlelhető¹. Populációs tanulmányok alapján a betegség prevalenciája 10 – 20%¹–³ . Az 50 év felettiekben 25%-kal kevésbé gyakori, mint az ennél fiatalabbakban³, továbbá nőkben kb. másfélszeres az előfordulása a férfiakéhoz képest.
Mivel a betegségnek nincs specifikus markere, a tünetek alapján, a Rome IV kritériumok szerint diagnosztizálják³:
három hónapon keresztül heti legalább egy alkalommal előforduló hasi fájdalom, melyre az alábbiak közül további legalább 2 kritérium teljesül³:
• székletürítéssel összefügg
• megváltozik a székelés gyakorisága
• megváltozik a széklet megjelenése (konzisztenciája).
A fentiek kiegészíthetők a Manning kritériumokkal, melyekhez hozzátartozik a fájdalom kezdetének értékelése, a nyákürítés megléte vagy hiánya, az inkomplett székletürítés érzete:
1. táblázat: Manning kritériumok5,30 – az IBS valószínűsége a kritériumok számával arányos

Egy 2013-ban végzett validációs tanulmány a Rome kritériumokat érzékenyebbnek, a Manning kritériumokat specifikusabbnak találta6.
Az IBS altípusokat¹‚³ a bélhabitus alapján, a széklet konzisztenciáját a Bristol skála7 (Bristol Stool Form Scale, BSFR) szerint állapíthatjuk meg:
• IBS-C – a székrekedés (constipatio) dominál
• IBS-D – a hasmenés (diarrhoea) dominál
• IBS-M – kevert (mixed) altípus: székrekedés és hasmenés váltakozik
• IBS-U – nem osztályozható (unclassified), a fenti 3 csoport egyikébe sem sorolható.
Az altípusok használata vitatotott, ugyanis az IBS-C páciensek 29%-a IBS-D altípusba vált át és általában a páciensek 75%-a 1 éven belül típust vált¹.
Az American College of Gastroenterologists (AGA) szerint részletes kivizsgálás szükséges az 50 év felettieknél továbbá azon 50 év alatti IBS betegek esetén, akiknél az alábbi „alarm tünetek érzékelhetők8:
• súlyesés
• vashiányos anaemia
• a családi anamnézisben gasztroenterológiai betegség (pl. IBD, cöliákia, colorectalis carcinoma)szerepel.
A kórkép kialakulásának okai jelenleg sem tisztázottak egyértelműen. A gyomor-bélrendszer motilitására és a zsigeri túlérzékenységére fókuszálnak főként, emellett a gyulladásos folyamatok szerepe, a mikrobák összetételének változása, a bakterialis túlnövekedés (a felsőbb bélszakaszokon), ételérzékenység és genetikai hajlam is a vizsgálandó tényezők közé tartozik².
Számos tanulmány a puffadás visceralis afferens idegek hiperszenzitizációját kiváltó hatását tartja a túlérzékenység okának, melynek kialakulásában a lokális idegrendszernek, az agyban történő modulációnak és speciális gasztrointesztinális modulátoroknak (szerotonin, kininek) is szerepe lehet².
A bélnyálkahártya immunrendszerének aktivációja (főként fertőzés után kialakuló) ISB-D típusban kifejezettebb: fokozott lymphocyta infiltráció a plexus myentericusban, megnövekedett hízósejt szám a jejunumban, ileumban és vastagbélben9,10. A plazma pro-inflammtorikus citokinek szintje megemelkedett¹¹. A hízósejtek szerepét az IBS kórélettani folyamataiban az előző összefoglalónkban [„A hízósejtek (mastocyták) szerepe a funkcionális gyomor-bélrendszeri rendellenességekben (FGID-ben)] tárgyaltuk27-29.
Poszt-infekciós IBS esetén akut enteritises hasmenés előzi meg az IBS kialakulását. A fertőzés bakterialis, protozoon, féreg vagy vírus eredetű lehet. Akut fertőzéses gastroenteritis után mintegy 6-szor gyakoribb az IBS kialakulása12,13. Egy 2021 januárjában megjelent állatkísérletes tanulmány szerint bizonyos gastrointestinalis kórokozókkal történő fertőzés helyi (nem szisztémás) IgE-közvetítette hízósejt aktivizálódást okoz, ami tipikus IBS tünetekkel jár. IBS betegek és egészségesek belébe (rectosigmoidealis szakasz) gyakori allergéneket (tehéntej, szója, glutén) juttatva, IBS betegekben lokális immunválaszt mutattak ki, ugyanakkor egészségesekben nem volt látható reakció38. Mindezek alapján a szerzők hízósejt aktivitást gátló szerek használatát javasolják a kezeléshez.
A bélflóra megváltozása szintén szerepet játszik az IBS manifesztációjában (állatkísérletben igazolt)14. Bizonyos probiotikumok javítanak a tüneteken, ugyanakkor a mikrobiota összetételének megváltozása adásuk alatt nem mutatható ki.
Örökletes tényezők csak mérsékelten játszanak szerepet az IBS kifejlődésében, monozigóta ikrekben gyakrabban figyelhető meg a kórkép halmozódása, mint dizigótákban15. A familiaritáson túl a szociális hatások szerepe nagyobb16.
Pszicho-szociális faktorok (szorongás, alvászavar) hatása az IBS kifejeződésében jelentős lehet17. IBS betegekben gyakoribb a szorongás, depresszió, fóbia és a szomatizáció18.
Ételérzékenység és IBS
Az IBS betegek jelentős részében feltételezik a szénhidrátok malabszorpcióját. Eredetileg ezt IBD betegeken igazolták, később bebizonyosodott az IBS betegcsoportra is³. Elsősorban a fermentábilis oligo-, di-, monoszacharidok (fruktóz, galaktóz) és poliolok (cukoralkoholok) bevitele okozhat panaszokat, ezért javasolják a FODMAP szegény étrend bevezetését³.
Bár az IBS betegekben gyakoribb az étel prick teszt pozitivitása19, a pozitív ételekkel történő terhelés azonban nem okozta a tünetek súlyosbodását². IBS betegek, funkcionáklis dyspepsiás páciensek és normál kontroll csoport ételkomponens IgE szintjében nem találtak szignifikáns eltérést23.
Az eliminációs diéta az ételkomponensek ellen termelődött IgG teszt eredményére alapozható23,32. Ilyen antitestek keletkezésének oka a bélhez asszociált immunrendszer aktivizálódása lehet, részben a megváltozott bél permeabilitás, részben az M-sejteken keresztül bejutó antigének ingerhatása miatt23.
Ezt a kezelési lehetőséget az akadémiai orvoslás még nem tartja egyértelműen bizonyítottnak², ugyanakkor számos prospektív, randomizált vizsgálat az IgG teszten alapuló eliminációs étrend jótékony hatását alátámasztani látszik.
Egy 5 289 különböző (gyomor-bélrendszeri, légzőszervi, bőrgyógyászati, ideggyógyászati, mozgásszervi, pszichológiai) problémákkal küszködő páciensnek végezett IgG ételintolerancia vizsgálatot, s elemezték a teszten alapuló eliminációs diéta alkalmazásának hatását, figyelembe véve, mennyire szigorúan tartották be a résztvevők az étrendváltoztatást33.
A diétát szigorúan betartók között legnagyobb arányban (>80%) a gyomor-bélrendszeri betegek számoltak be kifejezett – jelentős javulásról a diéta hatására, de ez az arány a többi csoportban is meghaladta a 70%-ot, kivéve a mozgásszervi problémákra panaszkodókat (64%-uknak enyhültek jelentősen a tüneteik). A vizsgált egyének jelentős része azt is kipróbálta, mi történik, ha ismét elkezdi fogyasztani a pozitív eredményt adó ételt: 77%-kuk a tünetek újra megjelenését tapasztalta. A diétát eredetileg szigorúan betartók 92%-a számolt be az állapot romlásról a pozitív étel ismételt fogyasztása után33.
Egy randomizált tanulmányban 150 IBS pácienst vizsgáltak 12 héten keresztül20. Mindenkinek ételkomponens ellenes IgG titert határoztak meg. A résztvevők felénél (n=75) a pozitív ételeket eliminálták az étrendből (valódi eliminációs csoport), míg a vizsgáltak másik felében ugyanannyi teszt-negatív ételt elimináltak az étrendből, mint ahány pozitív volt (áldiétás csoport). A vizsgálat befejezésekor a valódi diétás csoportban 65, az áldiétás csoportban 66 beválasztott személy volt értékelhető. A következőket értékelték (0-500 skálán):
• IBS tünet súlyossági score (fájdalom, puffadás, bélműködés, általános jólét);
• nem-colon tünetek score (letargia, hátfájdalom, hányinger, vizelési panaszok);
• életminőség (quality of life, QOL) score;
• szorongás és depresszió (hospital anxiety and depression, HAD)
• mindezek mellett értékelték a globális tüneti változást (a diéta hatására elviselhetetlenül rosszabb lett, rosszabb lett, enyhén romlott, nem változott, enyhén javult, kiváló lett a közérzet).
A 12. hét végére szignifikánsan javult a valódi diétát kapók állapota az áldiétázókéhoz képest. A különbség az étrendváltoztatást teljes mértékben betartókénál lényegesen magasabb lett.
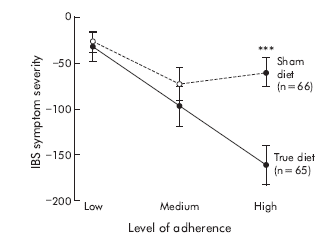
2. ábra a cikkben20: Az IBS tünetek súlyosságának változása a két csoportban, a diéta betartása szerint (alacsony – közepes – jó adherencia)
3. ábra a cikkből20: a nem-colon tünetek, a QOL és a HAD score változása diéta hatására
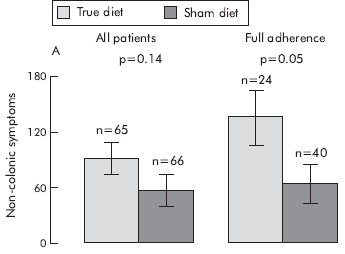
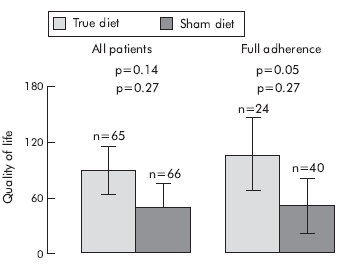
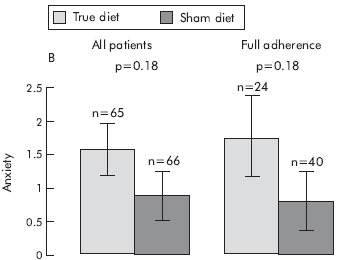
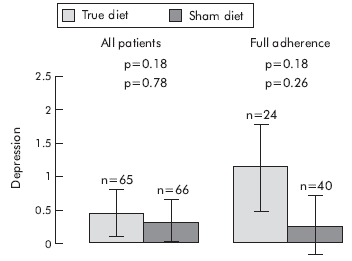
A tanulmány adatai azt igazolják, hogy a szigorúan betartott, IgG teszten alapuló étrendváltozás jelentősen javít az IBS betegek állapotán.
Egy másik tanulmányban standard gyógyszeres terápiára nem reagáló IBS betegeket vizsgáltak24: ételkomponens ellenes IgE, IgG szinteket mértek valamint microbiome analízist és kilégzési tesztet (8 órás éhezést követően alapszint, majd glukóz oldat itatását követően 3 órán keresztül hidrogén és metán szint mérést) végeztek, továbbá kérdőívvel értékelték az IBS specifikus specifikus tüneteket és az életminőséget (IBS-QOL). A pácienseket IgE és IgG-teszt alapján beállított eliminációs diétában részesítették. 3-4 héten át tartó szigorú diétát követően egyenként (3-4 naponként) a pozitív ételek visszavezetését kísérelték meg. A tolerálható ételekre ettől kezdve rotációs étrendet állítottak be, a nem tolerálható komponenseket továbbra is kihagyták a diétából, fél éven keresztül. A napitáplálkozásról részletes naplót vezettek. A páciensek probiotikumot kaptak (naponta) a 2-6. hónap között, végén 1 hónapos szünetet tartva. Az alkalmazott probiotikum összetétele: Lactobacillus acidophilus, Bifidobacterium bifidum, L. rhamnosus, L plantarum, B. infantis, L. salivarius, L. bulgaricus, L. casei, L. brevis és Streptococcus thermophilus. Az említett, vizsgálat előtt végzett teszteket 6 hónap múlva ismételték.
A kezdeti vizsgálatok során diszbiótikus flórát állapítottak meg (a Lactobacillus és Bifidobacterium fajok, továbbá az E. coli kolóniák száma csökkent volt a normál populációéhoz képest). A vizsgálat végén ellenőrizték a bélflóra összetételét. Ugyan javuló tendenciát észleletek, de a változás nem volt szignifikáns. Akiknél a kilégzési teszt pozitívnak bizonyult, a probiotikum szedést követően nem javult az értékeik.
Az eliminációs/(és részben) rotációs diéta hatására szignifikánsan javultak IBS tüneteik és életminőségük. A javulásban a probiotikumok kevesebb szerepet játszottak.
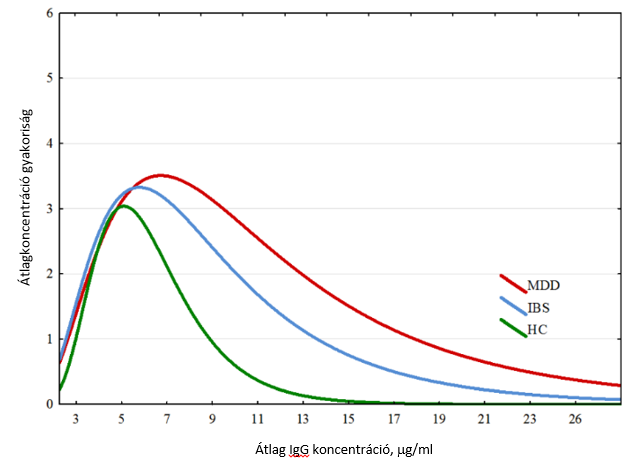
Az IgG alapú diétának az IBS tüneteinek mérséklése mellett a fő depresszív rendellenességek (major depressive disorder, MDD) javulásában is szerepe lehet. Ezt vizsgálta Karakula-Juchnowicz H. és munkatársainak tanulmánya25, melyben MDD, IBS és egészséges kontroll (healthy control, HC) betegeket hasonlítottak össze. Ételkomponens IgG szintet vizsgáltak mindhárom csoportban. Ebben szignifikáns különbséget találtak az IBS és HC, továbbá az MDD és HC csoportok között. Az MDD páciensekben magasabb értékeket kaptak gluténre az IBS betegekéhez képest, így valószínűsíthető, hogy az eliminációs étrend javít a tüneteken – ezt megfelelő prospektív, randomizált, kettősvak tanulmányokkal kell majd bitonyítani.
A kapott IgG értékek különbségeit jól mutatja az alábbi ábra25:
Az IgG antitestek feltételezett szerepét a depressziós panaszokkal küzdő páciensekben az alábbi ábrában foglalták össze25:
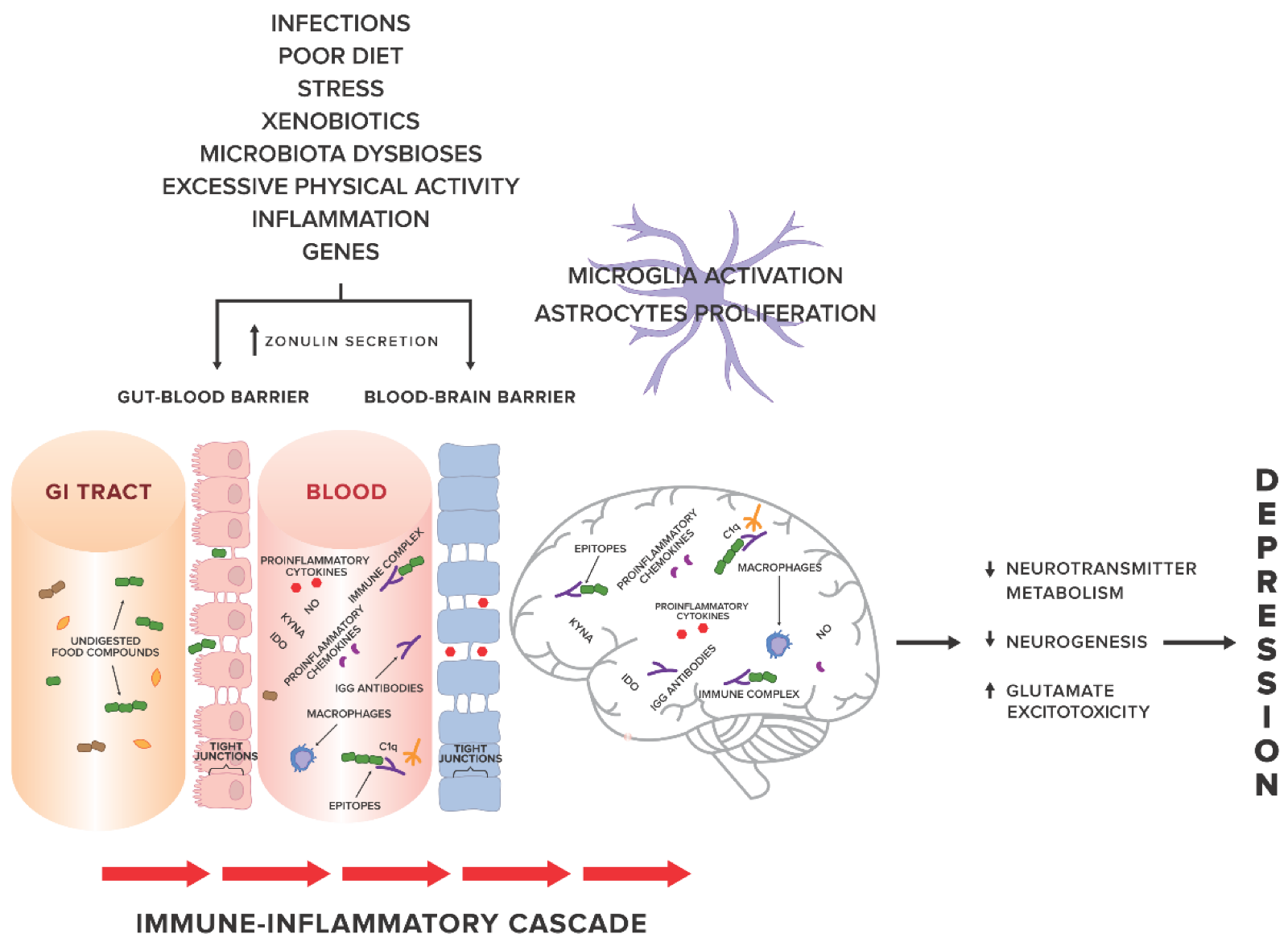
Genetikai és környezeti tényezők a tight junction károsodásához vezetnek mind a beleket, mind a vér-agy gátat tekintve. A bél barrier károsodása miatt a nem megfelelően lebontott molekulák a véráramba kerülnek, ahol az ellenük termelődött IgG antitestek velük immunkomplexeket hoznak létre, gyulladásos folyamatokat indukálnak. Ez az alacsony szintű, kontrollálatlan, szisztémás gyulladás neuroinflammációhoz vezet, kóros folyamatok alakulnak ki a központi idegrendszerben, s a neurotranszmitterek metabolizmusának változása, a neurogenezis károsodása, a glutamát excitotoxicitás következménye hosszantartó depresszió lesz.
Rövidítések: GI tract: gyomor-bél rendszer; KYNA: kinureninsav; NO: nitrogén-oxid; IDO: indolamin-2,3-dioxigenáz, C1q: komplement komponens
Egy esettanulmányban felvetődik a gyógyszeradásra bekövetkező allergiás reakció szerepe a bél áteresztőképességének romlásában és a (búzafehérjék elleni) ételintolerancia kialakulásában29. Egy előzőleg teljesen egészséges páciens fogászati műtéten esett át. Az alkalmazott medikáció (anesztetikumok, antibiotikumok, fájdalomcsillapítók) súlyos allergiás reakciót váltott ki. A következő hetekben 1-3 órával az ételfogyasztást követően IBS-szerű tüneteket észlelt. A cöliákia specifikus antitestek, a HLA DQ2 és DQ8 negatívnak bizonyult. A tight junction fehérjék (occludin/zonulin) lipopoliszaccharidok, actomyosin ellen antitestek jelentek meg, mely a fokozott bélpermeabilitást támasztja alá. Glutén, gabonafehérjék és egyéb ételek elleni IgG és IgA szint emelkedett volt. Az eliminációs diétát követő 6 hónappal a panaszok megszűntek, az antitestszintek a referencia tartonmányba estek vissza.
Számos tanulmány igazolja, hogy az IBS és a cöliákia tünetei között átfedés tapasztalható34,35. Az IBS betegek egy csoportjában a gluténmentes étrend jelentősen enyhíti a tüneteket, ugyanakkor a cöliákia nem igazolható (nem cöliákiás glutén/búza érzékenység)31. Az IBS-D csoportba sorolható, HLA-DQ2 pozitív, de szerológia és szövettan negatív páciensek, akikben az anti-gliadin IgG (AGA IgG) pozitivitás mutatható ki, nagy valószínűséggel ebbe a csoportba tartoznak36. A nem cöliákiás, HLA-DQ2/DQ8 pozitív, IBS-D páciensekben a bélpermeabilitás fokozott a HLA-DQ2/DQ8 negatívakéhoz képest37.
Irodalom https://doi.org/10.1053/j.gastro.2015.02.005
- J K Lehrer, G R Lichtenstein: Irritable Bowel Sydrome Emedicine Medscape 2019, https://emedicine.medscape.com/article/180389
- A Wald: Clinical manifestations and diagnosis of irritable bowel syndrome in adults – UpToDate, 2019 (last update), https://www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-irritable-bowel-syndrome-in-adults
- A Wald: Pathophysiology of irritable bowel syndrome – UpToDate, 2020 (last update), https://www.uptodate.com/contents/pathophysiology-of-irritable-bowel-syndrome
- A Wald: Treatment of irritable bowel syndrome in adults – UpToDate, 2020 (last update), https://www.uptodate.com/contents/treatment-of-irritable-bowel-syndrome
- Manning AP, Thompson WG, Heaton KW, Morris AF (1978). “Towards positive diagnosis of the irritable bowel”. Br Med J. 2(6138): 653–4. doi:1136/bmj.2.6138.653
- Ford, Alexander C.; Bercik, Premysl; Morgan, David G.; Bolino, Carolina; Pintos–Sanchez, Maria Ines; Moayyedi, Paul (Dec 2013). “Validation of the Rome III criteria for the diagnosis of irritable bowel syndrome in secondary care”. Gastroenterology. 145(6): 1262–70.e1. doi:1053/j.gastro.2013.08.048
- M R Blake, J M Raker, K Whelan: Validity and reliability of the Bristol Stool Form Scale in healthy adults and patients with diarrhoea‐predominant irritable bowel syndrome, Alimentary Pharmacol Ther 2016, 44:693-703, https://doi.org/10.1111/apt.13746
- Brandt LJ, Chey WD, Foxx-Orenstein AE, et al, for the American College of Gastroenterology Task Force on Irritable Bowel Syndrome. An evidence-based position statement on the management of irritable bowel syndrome. Am J Gastroenterol. 2009 Jan. 104 suppl 1:S1-35.
- Peter R. Gibson, Jane Varney, Sreepurna Malakar, Jane G. Muir: Food Components and Irritable Bowel Syndrome, Gastroenterology 2015, 148(6):1158-11474, https://doi.org/10.1053/j.gastro.2015.02.005
- Halmos EP, Power VA, Shepherd SJ, Gibson PR, Muir JG. A diet low in FODMAPs reduces symptoms of irritable bowel syndrome. Gastroenterology 2014, 146(1):67-75, https://doi.org/10.1053/j.gastro.2013.09.046
- Jørgen Valeur, Milada Cvancarova Småstuen et al.: Exploring Gut Microbiota Composition as an Indicator of Clinical Response to Dietary FODMAP Restriction in Patients with Irritable Bowel Syndrome, Dig Dis Sci63, 429–436 (2018). https://doi.org/10.1007/s10620-017-4893-3
- Heather Halvorson;Carey Schlett;Mark Riddle: Postinfectious Irritable Bowel Syndrome—A Meta-Analysis, American Journal of Gastroenterology. 101(8):1894–189, https://org/10.1111/j.1572-0241.2006.00654.x
- M Thabane, D T Kottachchi, J K Marshall: Systematic review and meta‐analysis: the incidence and prognosis of post‐infectious irritable bowel syndrome, Aliment Pharmacol Ther 2007, 26(4):535. https://doi.org/10.1111/j.1365-2036.2007.03399.x
- Crouzet L, Gaultier E, et al.: The hypersensitivity to colonic distension of IBS patients can be transferred to rats through their fecal microbiota, Neurogastroenterol Motil. 2013, 25(4):e272-82, https://doi.org/10.1111/nmo.12103
- Mohammed I, Cherkas LF, Riley SA, Spector TD, Trudgill NJ: Genetic influences in irritable bowel syndrome: a twin study, Am J Gastroenterol. 2005, 100(6):1340, https://doi.org/1111/j.1572-0241.2005.41700.x
- Levy RL, Jones KR, Whitehead WE et al.: Irritable bowel syndrome in twins: heredity and social learning both contribute to etiology, Gastroenterology. 2001, 121(4):799, https://doi.org/1111/j.1572-0241.2005.41700.x
- L Chang: The role of stress on physiologic responses and clinical symptoms in irritable bowel syndrome, Gastroenterology. 2011, 140(3):761, https://doi.org/1053/j.gastro.2011.01.032
- Solmaz M, Kavuk I, Sayar K: Psychological factors in the irritable bowel syndrome, Eur J Med Res 200, 8(12):549
- Jun DW, Lee OY et al.: Food intolerance and skin prick test in treated and untreated irritable bowel syndrome, World J Gastroenterol. 2006;12(15):2382, https://org/10.3748/wjg.v12.i15.2382
- W Atkinson, T A Sheldon, N Shaath, P J Whorwell: Food elimination based on IgG antibodies in irritable bowel syndrome: a randomised controlled trial, Gut 2004, 53:1459-1464, https://doi.org/1136/gut.2003.037697
- S Evangelista: Benefits from Long-Term Treatment in Irritable Bowel Syndrome, Gastroenterology Research and Practice 2012, Article ID 936960, https://doi.org/10.1155/2012/936960
- L Agréus, K Svärdsudd et al.: Natural History of Gastroesophageal Reflux Disease and Functional Abdominal Disorders: A Population-Based Study, Am J Gastroenterol 2001, 96(10):2905-2914, DOI:1111/j.1572-0241.2001.04680.x
- X L Zuo, Y Q Li et al.: Alterations of food antigen-specific serum immunoglobulin G and E antibodies in patients with irritable bowel syndrome and functional dyspepsia, Clin Exp Allergy 2007, 37:823-830, https://doi.org/10.1111/j.1365-2222.2007.02727.x
- J Drisko, B Bischoff et al.: Treating Irritable Bowel Syndrome with a Food Elimination Diet Followed by Food Challenge and Probiotics, J Am Coll Nutr 2006, 25(6):514-522, https://doi.org/10.1080/07315724.2006.10719567
- H Karakula-Juchnowicz, M Gałęcka et al.: The Food –Specific Serum IgG Reactivity in Major Depressive Disorder Patients, Irritable Bowel Syndrome Patients and Healthy Controls, Nutrients 2018, 10:548, https://doi.org/3390/nu10050548
- N A Pullen, Y T Falanga et al.: The Fyn-STAT5 pathway: a new Frontier in IgE- and IgG-mediated mast cell signalling, Frontiers in Immunology 2012, 3: Article 117, https://doi.org/10.3389/fimmu.2012.00117
- M M Wouters, M Vicaro, J Santos: The Role of Mast cells in functional GI Disorders, Gut 2016, 65:155-168 http://dx.doi.org/10.1136/gutjnl-2015-309151
- T C Theoharides, K-D Alysandratos et al.: Mast cells and inflammation, Biochim Biophys Acta 2012, 1822(1):21-33, https://doi.org/10.1016/j.bbadis.2010.12.014
- A Vojdani, J Lambert: The onset of enhanced intestinal permeability and food sensitivity triggered by medication used in dental procedures, Case Reports in Gastrointestinal Medicine 2012, Article ID 265052, https://doi.org/10.1155/2012/265052
- L J Talley, R Spiller: Irritable bowel syndrome: a little understood organic bowel disease?, Lancet 2002, 360(9332):555-564, https://doi.org/10.1016/S0140-6736(02)09712-X
- P Mansueto, A D’Alcamo et al.: Food allergy in irritable bowel syndrome: The case of non-celiac wheat sensitivity, World J Gastroenterol 2015, 21(23): 7089-7109, https://org/10.3748/wjg.v21.i23.7089
- G E Mullin, K M Swift et al.: Testing for Food Reactions_ The Good, the bad and the Ugly, Nutrition in Clinical Practice 2010, 25(2):192-198, https://doi.org/10.1177/0884533610362696
- G Hardman, G Hart: Dietary advice based on food-specific IgG results, Nutrition and Food Science 2007, 37(1):16-13, https://doi.org/10.1108/00346650710726913
- Sanders DS, Carter MJ et al.: Association of adult coeliac disease with irritable bowel syndrome: a case-control study in patients fulfilling ROME II criteria referred to secondary care. Lancet 2001, 358(9292):1504, https://doi.org/1016/S0140-6736(01)06581-3
- Verdu EF, Armstrong D, Murray JA: Between celiac disease and irritable bowel syndrome: the “no man’s land” of gluten sensitivity, Am J Gastroenterol. 2009, 104(6):1587.
- Wahnschaffe U, Schulzke JD et al.: Predictors of clinical response to gluten-free diet in patients diagnosed with diarrhea-predominant irritable bowel syndrome, Clin Gastroenterol Hepatol. 2007, 5(7):844, https://doi.org/1016/j.cgh.2007.03.021
- Vazquez-Roque MI, Camilleri M et al.: A controlled trial of gluten-free diet in patients with irritable bowel syndrome-diarrhea: effects on bowel frequency and intestinal function, Gastroenterology 2013 May, 144(5):903-911.e3, https://doi.org/1053/j.gastro.2013.01.049
- Aguilera-Lizarraga, J., Florens, M.V., Viola, M.F. et al.Local immune response to food antigens drives meal-induced abdominal pain. Nature (2021). https://doi.org/10.1038/s41586-020-03118-2



