A hízósejtek (mastocyták) szerepe a funkcionális gyomor-bélrendszeri rendellenességekben (FGID-ben)
szerző: Dr. Krkos Károly
Bevezetés
A hízósejtek szerepét legintenzívebben atópiás reakciókban, parazita fertőzésekben vizsgálták. Újabb tanulmányok autoimmun gyulladásos folyamatokban, atherosclerosisban, bakterialis fertőzésekkel szembeni rezisztenciában is felvetik részvételét3.
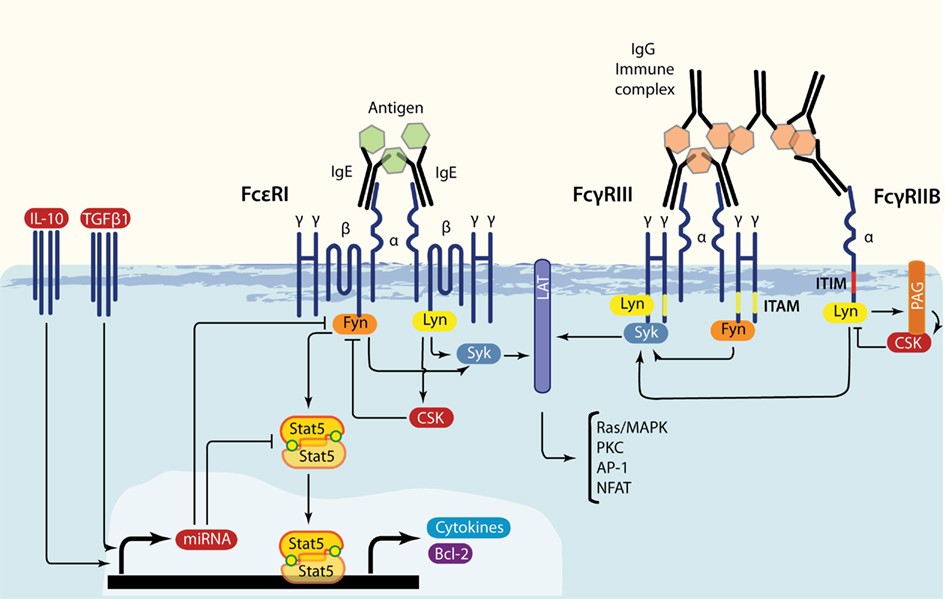
Az allergének hatása az FcεRI receptorhoz kapcsolódott IgE molekulák keresztkötésén keresztül valósul meg. Az aktiváció során kifejlődő jelképzéshez a kinázok Src családjának két tagja: Lyn és Fyn szükséges. Fyn aktiválja a STAT5-öt, mely a hízósejt túléléshez és a citokin termeléshez szükséges. Regulátoros citokinek – IL-10 és TGFβ – a Fyn és STAT5 termelést gátolni képesek – feltehetőleg specifikus miRNS indukción keresztül3.
A hízósejt FcγRI, FcγRIII és FcγRIIB receptorokat is expresszál a felszínén. Az FcϒRI és FcγRIII receptor gazda ellenes IgG-t vagy IgG-fehérje immunkompexet köt és az hasonlóan az FcεRI receptoron keresztül induklálódó jelképzés révén pro-inflammatorikus molekulák keletkezését váltja ki. Az FcγRIIB receptoron keresztül ellenregulatoros hatás, anti-inflammatorikus molekulák képződése valósul meg3 (ld. 1. ábra).
1. ábra Jelképzés az FcεRI, FcγRIII és FcγRIIB receptorok aktiválásán keresztül3

A hízósejtek érése a szöveti mikrokörnyezet és citokinek (főként a stem cell factor, SCF) hatása alatt áll. A hízósejt érésben szerepet játszó további molekulák: NGF (nerve growth factor), neurotrophin-3. A mastocytákat a folyamat helyszínére irányító molekulák (kemoattraktánsok): SCF, MCP-1 (monocyte chemoattractant protein-1 – vagy CCL2), RANTES (Regulated upon Activation, Normal T-cell Expressed and Secreted – vagy CCL5)1.
Az aktivált hízósejtek a szemcséikben vazoaktív és proinflammatorikus anyagokat tárolnak: hisztamint, szerotonint, tumor nekrózis faktort (TNF-t), kinineket, proteázokat. A proteázok a plazma albuminból hisztamin-felszabadító peptideket (histamine release peptides, HRP) hasítanak le,továbbá aktiválják a proteáz-aktiválta receptort (PAR), mely permeabilitás fokozódást okoz1.
Az aktiváció során a következő molekulák is szintetizálódnak: leukotriének, prosztaglandinok, vérlemezke aktiváló faktor (platelet activating factor, PAF). Ezen felül néhány órával a stimulációt követően számos citokin (IL-1, -2, -3, -5, -6, -8, -9, -13, TNF) és VEGF (vascular endothelial growth factor) termelődik1.
A hízósejtek nemcsak a szemcséikben tárolt anyagok kidobására képesek, hanem degranuláció nélküli szelektív bioaktív anyag (IL-6, eikozanoidok, VEGF, TNF) kibocsátásra is, mely a a következő kórképekben játszik szerepet: arthritis, atópiás dermatitis, sclerosis multiplex1.
Az agyalapi mirigy ACTH (adreno-cortocotrop hormon) termelését és a mellékvesekérget aktiváló hipotalamusz hormon, a CRH immunsejtekben és hízósejtekben is képződik1.
A hízósejtek mind a veleszületett, mind a szerzett immunitásban valamint az autoimmunitásban is szerepet játszanak. Közreműködnek az autoimmunitásban kulcsszerepet játszó Th17-sejtek érésében1.
2.ábra: A hízósejtek szerepe különböző gyulladásos kórképekben1:
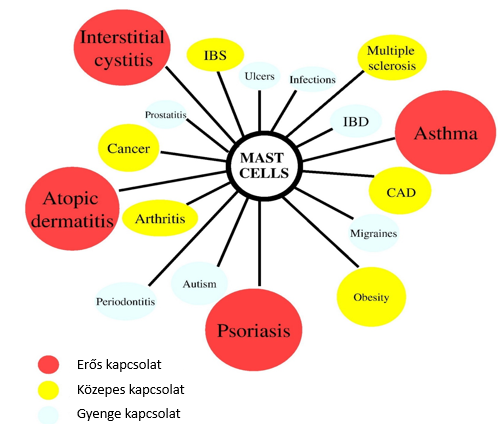
CAD, coronary artery disease; IBD, inflammatory bowel disease; IBS, irritable bowel syndrome

A hízósejtek szerepe a funkcionális gasztrointesztinális (GI) rendellenességekben (FGID-ben)
A funkcionális gyomor-bélrendszeri rendellenesséségekben (FGIDs) szenvedők beleiben a nyálkahártyák alatt főként hízósejtes, eosinophil sejtes beszűrődés észlelhető, s a táplálékfelvételt végző hámsejtek között az egészségesekhez képest több a lymphocyta (intraepithelialis lymphocyta). A bél-agy kommunikáció egyensúlyának megbomlása bélmozgás zavarokhoz, túlérzékenységhez vezet. Az FGID diagnózisát a tünetek alapján állítják fel, a Rome kritériumok szerint értékelik. Az ebbe a csoportba tartozó két leggyakrabban előforduló betegség a funkcionális diszpepszia (FD) és az irritábilis bél szindróma (IBS), mely a Föld népességének mintegy 16-26%-át érinti2. Jellegzetessége a károsodott bél áteresztőképességgel társuló alacsony szintű nyálkahártya gyulladás és a neuronalis érzékenység2.
A GI traktusban a hízósejtek szerepet játszanak:
• az ér és az epithelium áteresztőképességének szabályozásában,
• az ion szekrécióban,
• az érképződésben,
• bélmozgásban,
• fibrosis kialakulásában és a szövet helyreállításában,
• a veleszületett és szerzett immunitásban,
• sejtek toborzásában,
• baktériumok elleni védekezésben,
• fájdalom érzékelésben.
A hízósejtek (mastocyták, MC-k) aktivációjának szabályozása
A hízósejtek leghatásosabb stimulusa, ha a felszínükön lévő FcεRI receptoaikhoz kötött IgE molekulákkal az antigén keresztkökötést hoz létre. Ennek eredménye a degranuláció és a citokintermelés.
A hízósejtek IgG molekulákat (FcγRI), könnyű lánc molekulákat (IgLC), komplement termékeket is képesek megkötni, továbbá TLRs-t (toll like receptorokat) is tartalmaznak.
1. táblázat: A mastocytákat aktiváló molekulák: neurotranszmitterek, neuropeptidek, növekedési faktorok és hormonok:
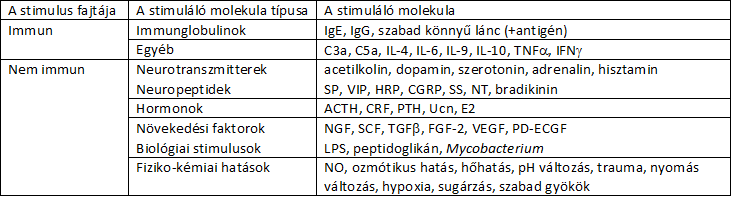

A bélben MC aktivációt okozó tényezők és mechanizmusok
MC aktivációt kiváltó ételantigének
Az FGID-ben szenvedő páciensek 28%-a ételfogyasztást követő 15 percen belül, 93%-a ételfogyasztást követő 3 órán belül a tünetek rosszabbodásáról számol be. Ugyan az IBS páciensek egy részében gyakrabban fordul elő atopia, az ételallergia nem mutat meggyőző kapcsolatot az FGID-vel. Ételintolerancia kialakulhat a hízósejtek IgG-közvetytette érzékenyebbé válásától is, de az IgG-mediálta immunreakciók szerepét az akadémiai orvoslás még nem tartja igazoltnak.
Amikor a gyanúba fogott élelmiszert endoszkópon keresztül közvetlenül az IBS betegek patkóbél nyálkahártyájára juttatják, azonnal felszívóhám károsodás figyelhető meg, megnövekszik az intervillosus tér és az intrepithelialis lymphocyták száma. Ezen élelmiszerek elvonása 1 év alatt a betegek 74%-ában tüneteik enyhüléséhez vezet. Ugyanakkor az élelmiszerre adott választ részben neuroendokrin tényezők szabályozzák (így a szerotoninerg válasz). A hízósejtek a szerotonint szintetizálni és szekretálni képesek triptofánból, továbbá a szerotonin a MCs egyik kemotaktikus faktora. A magas szerotonin tartalmú ételek (sajtok, húsok, szója, gabonafélék, diófélék, zöldségek) kellemetlen hatást válthatnak ki. Fűszeres ételek provokálhatják az IBS-t . A kapszaicin a nociceptív afferens C rostokon lévő TRPV1 (transient receptor potencial vanilloid 1) receptorok liganduma. Az FGID páciensekben a TRPV1 receptorokat expresszáló szenzoros rostok nagyobb sűrűsége volt kimutatható (az egészségesekhez képest). A hízósejtek közelsége a TRPV1 receptorokat expresszáló szenzoros idegrostokhoz, valamin a kapszaicin hízósejteket moduláló képessége a fűszeres ételek hatására kialakuló fájdalomra adhat magyarázatot. Ugyanakkor magas kapszaicin tartalmú étrenddel deszenzitizáció érhető el, a haspuffadás és fájdalom csökkenn 6-hetes kúrát követően.
Fertőzések hatása
Infekciós gastroenteritis FD és IBS kialakulásának fokozott kockázatával jár, de nem ismert, milyen tényezők vezetnek a panaszok krónikussá válásához. A hízósejtek mind a veleszületett, mind a szerzett – baktériumok, vírusok, paraziták, gombák elleni – immunfolyamatokban részt vesznek. A posztinfekciós, hasmenéssel járó IBS (IBS-D) betegekben a MC-k és plazmasejtek közelsége a hízósejtek immunglobulinok okozta aktivációjára utal.
A stressz szerepe
A krónikus stressz hízósejt aktivációhoz vezet. Stressz mediátorok, mint a CRF és ahhoz kapcsolódó peptidek módosítják az ion- és víz-elválasztást valamint a vastagbél paracelluláris és transzcelluláris permeabilitását – többek között az ideg – hízósejt kölcsönhatáson keresztül.
2. táblázat: A GI traktusban a hízósejtek számát megváltoztató – elsősorban fokozó – állapotok
• Allergiás betegségek: krónikus urticaria, étel allergia, atopia, herediter angiooedema
• Mastocytosis és hízósejt aktivációs szindróma
• Coeliakia: kezdeti fázisban fokozott, későbbi stádiumban csökkent a hízósejtes infiltráció
• Daganatok: neuroendokrin tumorok, lymphoma, epithelialis rákok, carcinoid szindróma
• Infekciós gyomor-bélrendszeri gyulladások: Helicobacter pylori gastritis, infekciós gastritisek, parazita fertőzések
• IBS, lymphocytás colitis
• Intestinalis pseudo-obstructio, diverticulitis
• Vasculitis, amiloidosis, gyógyszerek
Az FGID kórélettanára elsősorban a hízósejtek fokozott aktivitása (és nem azok emelkedett száma) a jellemző.
Az emberi bélben a hízósejtek a magas neuropeptid és TRPV1 receptor tartalmú szenzoros idegvégződésekhez közel helyezkednek el. A bél hízósejtjeinek afferens innervációja hisztamin és proteázok felszabadulását válthatja ki, s ezek a mediátorok parakrin módon fokozzák a gerincvelői afferens terminálok érzékenységét.
Az afferens ideg aktivációja myentericus kolinerg depolarizációt válthat ki és emiatt megváltozik a motoros működés.
3. ábra: Hízósejt – ideg kölcsönhatás. A hízósejt- ideg kétirányú kölcsönhatás a perisztaltikát és a fájdalom szignált módosítja. A hízósejtből felszabaduló bioaktív, pro-inflammatorikus anyagok az idegvégződésen különböző hatásokat (aktiváció, szenzitizáció, nociceptorok sejtmembránhoz toborzása, neurogén gyulladás) váltanak ki, mely végül visceralis hiperszenzitivitáshoz vezet. A neuronalis aktiváció neuropeptidek, neurotranszmitterek felszabadulását váltja ki, ami pedig tovább aktiválja a hízósejtet.
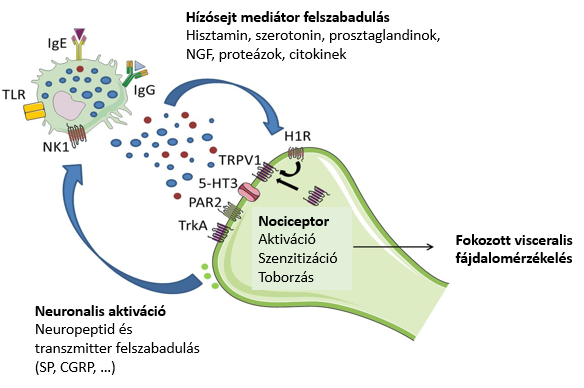

Az IBS páciensekben a bél nyálkahártyában és a nyálkahártya alatt fokozott a hízósejtekből származó mediatorok szintje, s ez az afferens idegek aktivációjához, fokozott visceralis fájdalomérzethez, megváltozott bélmotilitáshoz (hasmenés vagy székrekedés) vezet.
A hízósejtek szerepe az intestinalis barrier funkció szabályozásában
A hízósejtek szerepe a bál áteresztőképességének változásában akkor vetődött fel, mikor hízósejt stabilizátor adagolása a bélhámsejteken keresztül történt megnövekedett ion- és makromolekula- transzportot mérsékelte.
A hízósejt hatás mechanizmusa nem teljesen ismert, de ebben szerepet játszhat a hízósejtekből felszabaduló anyagok TJ fehérjéket szétbontó képessége. IBS páciensekban számos tight junction (TJ) fehérje expressziója csökkent a kontroll csoporthoz képest, IBS-D betegekben ez a jelenség összefüggést mutatott a hízósejtek aktivációjával és a klinikai tünetekkel. A MC-ből felszabaduló triptáz aktiválja a PAR2 receptort, ami a TJ megváltozásához vezet, s emiatt a bél makromolekulákat áteresztő képessége fokozódik. A hízósejtek egyéb mediátorai – a hisztamin, a kimáz és a prosztaglandin D2 befolyásolja a bélhám klorid-ion és víz szekrécióját valamint permeabilitását (4. ábra).
4.ábra: A hízósejtek és az intestinalis barrier funkció elemeinek kölcsönhatása: TJ moduláció és szekréciós válasz, egyéb immunsejtek toborzása, érfal működés megváltozása (permeabilitás, vérátáramlás mértéke), perisztaltika és fájdalom szignál.
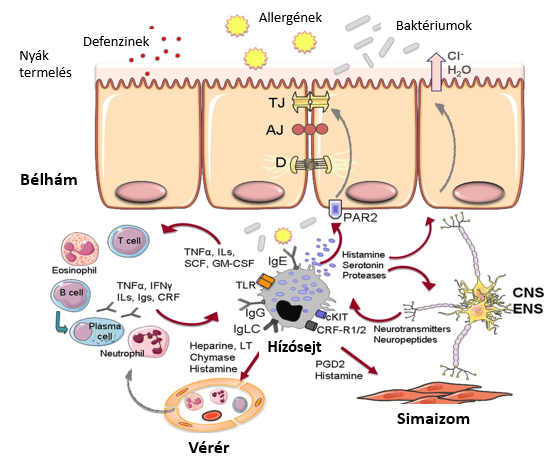

A hízósejtek és a bél-agy hálózat közti interakció szerepet játszik az FGID betegek egy részében, tünteteik kialakulásában.
Az FGID páciensek hízósejteket célzó kezelései
A hízósejteket stabilizáló dinátrium-kromoglikát (DSCG) megszűnteti az akut pszichológiai stresszt és a fokozott vékonybél permeabilitást.
Gyulladáscsökkentő hatású mesalazine 36%-kal csökkenti a MC számát valamint jelentősen csökkenti a totál immunsejtek és T-sejtek számát a vastagbél nyálkahártyában.
Palmitoil-etanolamid és egyéb kannabinoid receptor gátlók hatásosak a fájdalom kontroll, a motoros rendellenességek és a gyulladás csökkentésésében, az ideg- és nem idegsejtek (így a hízósejtek) módoulálásával.
750 mg/nap lassú felszívódású C-vitamin fokozza a hisztamin lebontását, gátolja a hízósejt degranulációt.
Természetes flavonoidok (fisetin, kaempferol, kvercetin, rutin, luteolin) és a berberin (benzil-izokinolin alkaloida) gátolja a mediátorok felszabadulását a hízósejtekből (epithelium barrier védelme).
IRODALOM
1. T C Theoharides, K-D Alysandratos et al.: Mast cells and inflammation, Biochim Biophys Acta 2012, 1822(1):21-33, https://doi.org/10.1016/j.bbadis.2010.12.014
2. N A Pullen, Y T Falanga et al.: The Fyn-STAT5 pathway: a new Frontier in IgE- and IgG-mediated mast cell signalling, Frontiers in Immunology 2012, 3: Article 117, https://doi.org/10.3389/fimmu.2012.00117
3. M M Wouters, M Vicaro, J Santos: The Role of Mast cells in functional GI Disorders, Gut 2016, 65:155-168 http://dx.doi.org/10.1136/gutjnl-2015-309151



