Az étrendi szokások a kardiometabolikus betegségek (szívbetegségek, stroke, 2 típusú diabétesz) legfőbb befolyásolói.1 Az Egyesült Államokban pl. a nem megfelelő diéta okozza a kardiometabolikus halálozás csaknem felét, ami 1000 ember halálát jelenti naponta.2 Az ebből adódó egészségügyi és gazdasági teher megdöbbentő.3
Az utóbbi években a táplálkozástudomány átalakult a bizonyítékok robbanásszerű gyarapodása, fény derült kulcsfontosságú vegyületekre és folyamatokra, melyek megvilágították, hogyan befolyásolja az étrend az egészséget és jólétet. Ezek közül a számos növényben megtalálható flavonoidokkal, bioaktív fitokemikáliákkal valamint a tejtermékekkel (tej, joghurt, sajtok) kapcsolatban születtek a legizgalmasabb felfedezések.
A fontos összetevőkkel és biológiai mechanizmusokkal kapcsolatosan felfedezett bizonyítokok előtérbe hozzák az élelmiszerek sokoldalú folyamatai kutatásának jelentőségét. Az alábbiakban beszámolunk a tudomány jelenlegi állásáról és azokról az innovatív felfedezésekről, melyek segítenek megérteni, hogy a flavonoidok és a tejtermékek milyen hatást gyakorolnak a kardiometabolikus egészségre, fókuszálva a kísérletes tanulmányokra, molekuláris mechanizmusokra és az ezeket alátámasztó klinikai bizonyítékokra.
Flavonoidok
FA flavonoidok polifenolos fitokemikáliák, melyek közé a következő vegyületek tartoznak:
flavonolok (vöröshagymában, brokkoliban, teában és különböző gyümülcsökben),
flavonok (petrezselyemben, zellerben és kamillateában),
flavanonok (citrusfélékben),
flavanolok (flavan-3-ol-ok) úgy, mint katechinek és
procianidinek (kakaóban, almában, szőlőben, vörösborban és teában),
anthocianidinek (színes bogyós termésűekben és a vörösborban) és az izoflavonok (szójában) (Tablázat).4–7
Táblázat: Flavonoidok alcsoportjai és tipikus ételforrásaik*,˦
* Az Egyesült Államokban fogyasztott fő flavonoidok 6 alcsoportja (antocianidinek, flavanols, flavanonok, flavonok, flavonolok és proantocianidinek),4 valamint izoflavonok, melyet a lakosság rendszeresen fogyaszt a magas szója és hüvelyes bevitellel.5
˦ A procianidinekre vonatkozó fő ételforrások Gu és mtsai6 a flavonoidok egyéb alcsoportjára vonatkozók Bondonno és mtsal7 cikke alapján kerültek a táblázatba.
| Flavonoidok | |||||||||||||
| Antocianidinek | Flavanolok (Flavan-3-ol-ok) | Flavanonok | Flavonok | Flavonolok | Pro-antocianidinek | Izoflavonok | |||||||
| Fő flavo-noid | Étel-forrás | Fő flavo-noid | Étel-forrás | Fő flavo-noid | Étel-forrás | Fő flavo-noid | Étel-forrás | Fő flavo-noid | Étel-forrás | Fő flavo-noid | Étel-forrás | Fő flavo-noid | Étel-forrás |
| cianidin, delfidin, malvidin, pelar-gonidin, peonidin, petunidin | bogyós gyümöl-csök, vörös-bor | katechinek, epi-katechinek | kajszi, kakaó, csoko-ládé, fekete szőlő, vörös-bor, tea | erio-diktiol, heszpe-ridin, narin-genin | citrus-félék, menta, para-dicsom | api-genin, lute-olin | zeller, petre-zsejem | izor-hamne-tin, kaemp-ferol, miri-cetin, kver-cetin | alma, áfonya, brokkoli, fodros kel, póré, vörös-hagyma, vörösbortea | tea-flavin, tea-rubi-gin | alma, csoko-ládé, szőlő | daid-zein, geni-stein, glici-tein | szója |
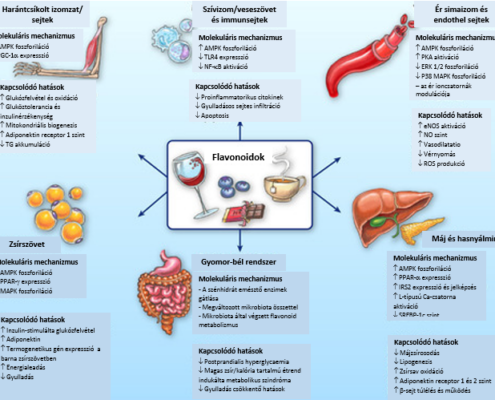
A flavonoidok szerkezeti sokfélesége hozzájárul ahhoz, hogy különböző specifikus molekuláris útvonalakat legyenek képesek modulálni. Fogyasztásukat követő felszívódásban, eloszlásban és kiürülésban meglévő különbségek tovább módosítják biológiai hozzáférhetőségüket, hatásuk helyét, és bioaktív metabolitjaik keletkezését.8 Míg néhány flavonoid felszívódása jó és sok szervben oszlik meg, mások felszívódása behatárolt – bár ezeknek is lehet szisztémás hatásuk, mivel interakcióba lépnek a mikrobiotával.9 Különösen az izoflavonok és a katechinek kardiometabolikus hatásait tanulmányozták (és ezekre terjed ki a jelen áttekintés).10–14 Amint az alább ismertetjük, meggyőző kísérleti adatok támasztják alá a flavonoidok számos élettani folyamatra gyakorolt hatását, melyek a kardiometabolikus betegségekkel összefüggésben állnak. (1. ábra)
1.ábra A flavonoidok kardiometabolikus előnyei and azok lehetséges molekuláris szintű mechanizmusai.
In vitro és állatkísérletes tanulmányok támasszák alá a tisztított flavonoidok és flavonoidokban gazdag növényi kivonatok biológiai aktivitását, melyet számos szövetre kifejtenek. Az érintett molekuláris folyamatok közé tartoznak:
a gének expressziójának és a jelátviteli útvonalak modulálása Az AMPK (5′-monofoszfát-aktiválta protein kináz) foszforilációjának és aktivációjának fokozása úgy tűnik, számos flavonoid fajta sajátja. Más jelátvitali utak modulálását is megfigyelték, úgymint PPAR-γ (peroxiszoma proliferátor-aktiválta receptor-γ) fokozott expressziója és az NF-κB (nukleáris faktor-κB) gátlásának aktivációja;
kölcsönhatásuk a bél mikrobiotával Az étellel bejutott flavonoidok megváltoztathatják a bél mikrobák összetételét probiotikum-szerű tulajdonságaik miatt, és bizonyos baktériumok (pl, Akkermansia muciniphila) növekedését stimulálják, melyek jótékony metabolikus hatást eredményez (pl. fenolos savak), melyek különleges tulajdonságokkal rendelkeznek és a keringésbe bejutva a szövetekben koncentrálódnak (szemben a kiinduló vegyülettel) így fokozva a flavonoid biológiai aktivitását;
közvetlen flavonoid–protein kölcsönhatások Egyre növekvő bizonyítékok arra utalnak, hogy a flavonoidok mind stimulálni, mind gátolni képesek fehérje funkciókat, így az erekben és a májban lévő ioncsatornákat és a gyomor-bélrendszerben található szénhidrátokat emésztő enzimeket (α-amiláz és α-glukozidáz). Ezek a hatások részben hozzájárulhatnak az értónus és a szénhidrát metabolizmus szabályozásához.
ERK1/2, extracelluláris szignál-regulálta kináz 1 és 2; GLUT4, 4 típusú glukóz transzporter; IRS2, inzulin receptor szubsztrát-2; MAPK, mitogán-aktiválta protein kináz; PGC-1α, peroxiszoma proliferátor-aktiválta receptor-γ koaktivátor-1α; PKA; protein kináz-A; SREBP-1c, szterol regulátoros elemen–kötő protein-1c; TG, trigliceridek; TLR4, toll-like receptor 4. (Illusztráció: Ben Smith.)
Mikrobák által előidézett flavonoid metabolizmus
A vastagbél mikrobiota a flavonoidokat kisméretű fenolos savakká és aromás metabolitokká képes enzimatikusan átalakítani.15,16 A táplálási tanulmányok arra utalnak, hogy ezek a metabolikus átalakulásból származó kis mennyiségű anyagcseretermékek teljesen felszívódnak a vastagbélből, fél-életidejük hosszabb és szisztémás koncentrációjuk magasabb lesz, mint a kiindulási molekuláé.17–19 Ezek a megfigyelések a mikrobák által létrehozott metabolitokra terelte a figyelmet, s arra, hogy ezek fejtik-e ki az étellel bevitt flavonoidok kardiometabolikus hatását. Az előzetes in vitro tanulmányok erre egybehangzó bizonyítékot szolgáltatnak. Élettani szempontból megfelelő dózisban számos mikrobiom eredetű fenolos metabolit gátolja a proinflammatorikus citokinek és vaszkuláris adhéziós molekulák termelődését a kiindulási flavonoid ilyen hatásával összehasonlítva.20–22 Számos mikroba eredetű flavonoid metabolit a hasnyálmirigy b-sejt működés-zavar és pusztulás ellen is véd.23
A táplálékkal bevitt flavonoidok a bél mikroba összetételét is megváltoztathatják mivel probiotikum-szerű tulajdonsággal rendelkeznek és bizonyos baktériumok növekedését serkenteni képesek.24,25 Az elhízás állatkísérletes modelljét használva, az állatokat flavonoidokkal táplálva, megváltozott a mikroba-közösség szerkezete, többek között emelkedett az Akkermansia muciniphila mennyisége,26–28 s ez kifejezett metabolikus előnnyel járt.29,30 A flavonoidok hatással lehetnek a bél mikrobiota rövidláncú zsírsavakat (SCFA – 2-6 szénatom) termelő képességére is.31 Az SCFA, főként az ecetsav (2:0), a propionsav (3:0), és a vajsav (4:0) a vastagbél baktériumainak hatására termelődik főként a nem emészthető vagy trosszul emészthető szénhidrátok (étrendi rostok) fermentációjával.32 Azon túl, hogy a mikrobák ááltal termelt SCFA energiaforrás, jelátvivő molekulaként is működik és hatással lehet a gazdaszervezet energia-metabolizmusára, a glukóz – inzulin homeosztázisra, endokrin hormonok (pl. GLP-1 – glucagon-like pepetide-1) termelődéséreés a gyulladásos folyamatokra. Néhány egér- és patkány-kísérletben az étellel bevitt SCFA védelmet biztosított a súlygyarapodás ellen, javította a glukóz toleranciát és fokozta az inzulinérzékenységet.33–36 Azonban ellentmondó eredmények is születtek: magas zsír-/nagy kalóriatartalmú étrenden tartott egereket szájon át vagy intravénásan acetáttal kezelve csökkent a táplálékfelvétel és a súlygyarapodás,36,37 ugyanakkor intragasztrikus infúzióval történő magas zsír/kalória-bevitel patkányokon ellenkező hatást váltott ki.38 Ezen különbségek oka nem tisztázódott, s ez ráirányította a figyelmet arra, hogy további, mechanisztikus és humán vizsgálatokra lenne szükség. Kísérleti bizonyítékok utalnak arra, hogy az SCFA élettani hatásait főként a számos sejten és szövetben (vastagbél, zsírszövet, központi idegrendszer) megtalálható GPR (G-protein–coupled receptors) receptoron keresztül fejti ki.39 Egyes SCFA más útvonalon is kifejtheti hatását: pl. patkényokban a táplálékkal bevitt propionsav pozitív metabolikus hatását GPR aktiváción keresztül fejti ki, míg a butirát nem.34 A GPR jelképzés40 vagy más mechanizmusok, mint epigenetikai módosítás41 magyarázhatja az SCFA vérnyomáscsökkentő és gyulladáscsökkentő hatását néhány sejtszintű és állatkísérletes tanulmányban.42,43 Az, hogy a bélben termelődött SCFA variabilitása milyen mértékben flavonoid függő, tisztázatlan maradt és az emberben a mikrobiota által termelt SCFA klinikai jelentőségét is magyarázni szükséges.44 Ennek ellenére a felszínre került átfogó bizonyítákok a flavonoid fogyasztás és a mikrobiota összetétel és működés közötti olyan kétirányú kölcsönhatásokat bizonyítanak, melyek a kardiometabolikus egészséggel összefüggő élettani útvonalakat megváltoztatják.
Glukóz – inzulin homeosztázis
Eddig nagyszámú állatkísérletes tanulmány tesztelte a tisztított flavonoid vegyületek vagy flavonoidban gazdag növényi kivonatok inzulin-glukóz hoeosztázisra gyakorolt hatását, számos ezek közül a flavonoidok jotékony szerepére utal.
| Nem standard rövidítések és mozaikszavak | |
| AMPK | 5′-monofoszfát-aktiválta protein kináz |
| BP | vérnyomás (Blood Pressure) |
| CHD | szív koszorúér betegség (Coronary Heart Disease) |
| CVD | szív-érrendszeri betegség (CardioVascular Disease) |
| GLP-1 | Glukagon-szerű peptid 1 (Glucagon-Like Peptide 1) |
| GPR | G-protein–kapcsolt (coupled) receptorok |
| MCSFA | közepes láncú telített zsírsavak (Medium-Chain Saturated Fatty Acids) |
| MFGM | tejzsír globuláris membránok (Milk Fat Globule Membranes) |
| MGP | mátrix glutamát protein (Matrix Glutamate Protein) |
| MK | menaquinone |
| mTOR | mammalian target of rapamycin |
| NF-κB | nuclear factor-κB |
| OCSFA | páratlan szénláncú telített zsírsavak (Odd-Chain Saturated Fatty Acids) |
A flavonoidok a glukóz metabolizmusra a vékonybélben, izomban, zsírszövetben, májban és hasnyálmirigyben többféle molekuláris mechanizmus révén lehetnek hatással. In vitro tenulmányok arra utalnak, hogy sokféle flavonoid a szénhidrát emésztésben és felszívódásban kulcs-szerepet játszó enzimet gátol, mint az α-amilázt, α-glukozidázt és a nátrium-függő glukóztranszportert, s ezáltal hozzájárul az étkezést követő csökkent vércukorszint emelkedéshez.45 A flavonoidok a glukóz-inzulin homeosztázist számos jelképző útvonalon keresztül javíthatják. Sejtkultúrával végzett és állatkísérletes tanulmányok szerint az 5′-adenozin-monofoszfát-aktiválta protein kináz (AMPK) és a PPAR-γ (peroxiszoma proliferátor–aktiválta receptor-γ) a két kulcsfontosságúő folyamat, amelyen keresztül néhány flavonoid fokozza az izmok glukóz-felvételét és javítja a zsírsejt működést.46–50 Állatmodellekben a flavonoid kezelés csökkenti a májban a zsír-felhalmozódást és javítja a máj inzulin-érzékenységét, mely kapcsolatban áll a de novo lipogenezis csökkentésével és a zsírsav β-oxidáció fokozásával.51–54 Végül a sejtes és állatkísérletes tanulmányok arra utalnak, hogy számos típusú flavonoid védi a hasnyálmirigy β-sejtjeit a glukóz toxikus és gyulladást kiváltó hatása valamint az inzulin-elválasztás fokozódása ellen.55–57
Az AMPK aktiváció közvetíti a flavonoidok inzulin-elválasztásra kifejtett hatását, de bizonyos flavonoidok más mechanizmusokban is – az intracelluláris kalcium membrán ioncsatorna aktivációján keresztül történő módosaításában – szerepet játszanak.58,59
A NO biológiai hozzáférhetősége, a redox státusz és a vazoreguláció
Állatkísérletekben flavonoidok adása vazorelaxációt és vérnyomáscsökkenést vált ki.60 A kulcsfontosságú útvonal, melyen keresztül a flavonoidok az erek egészségét szabályozzák, az a NO metabolizmus mind közvetlen mind közvetett úton történő megváltoztatása.7 Számos flavonoid képes közvetlenül fokozni az endotélsejtek NO-szintáz expresszióját és aktivitását (a NO fő forrása az érrrendszer), és így a NO.61–63 Az endotél NO szintáz szint emelése az AMPK aktivációján keresztül valósul meg.64 A flavonoidok közvetett módon képesek fokozni a NO biológiai hozzáférhetőségét úgy, hogy csökkentik az NO bomlását okozó reaktív oxigéngyökök termelődését vagy fokozzák ezen vagyületek eltávolítását. Különböző flavonoid alcsoportokkal történő kezelés fokozza a belső antioxidáns enzimek (nátrium-oxid-dizmutáz, kataláz) aktivitását, csökkenti a szuperoxid gyök NADPH-oxidáz által katalizált keletkezését és csökkentik az oxidatív stressz protein lés lipid biomarkereit.65–67 Ráadásul az erek működését nemcsak a nitrogén-monoxidon keresztül szabályozzák, hanem más NO-független folyamatra is hatnak, így közvetlenül képesek stimulálni vagy gátolni az erek kalcium-ion csatornáit.68
Testsúly fenntartás
Számos elhízással kapcsolatos állatkísérletes modellben flavonoidok adagolása megakadályozta az étrend-indukálta testsúly növekedést. Ezekben a vizsgálatokban a flavonoidok nem az energiaelvételre voltak hatással,69–72 hanem az energialeadás fokozódásával járultak hozzá a súly szabályozásához. Például a luteolin (borsban, almahéjban, sárgarépában bőségben található flavonoid) upregulálja az AMPK és a PGC-1α (PPAR-γ koaktivátor 1α) jelképzó kaszkádot és ez a barna valamint a bőralatti zsírszövetben fokozza a termogén gének expresszióját, ezáltal fokozva az energia leadást a magas vagy alacsony zsírdiétán tartott C57BL/6 egerekben.72 Más flavonoidokról is kimutatták, hogy indukálni képesek a barnazsírszövet-specifikus géneket és fehérjéket, zsírsejt-tenyészetben.73 Állat táplálási tanulmányokban további mechanizmusokat is megfigyeltek, melyen keresztül a flavonoidok képesek fokozni az energia-leadást, így a szimpatikus idegrendszer stimulációján keresztül74 és a vázizom mitokondrium biogenezis és működés fokozása útján.71,75 Számos flavonoid típus csökkent zsírképzést és fokozott zsírsav b-oxidációt okozott zsírsejtek tenyészetében és egerekben.76–78
Gyulladáscsökkentő hatások
Különböző gyulladásos stimulust alkalmazó (ischemia- reperfúzió, diabetes mellitus, gyógyszerhatás, magas zsír diéta) állatkísérletben néhány flavonoidról kimutatták, hogy gyulladáscsökkentő hatású zsír- és szívizom-szövetben.79–85 Ezekben a modellekben szájon át történő flavonoid adás redukálta a gyulladásos sejtes infiltrációt, csökkentette a proinflammatorikus citokinek szintjét és a szöveti fibrosist és javította a sejtek túlélését és működését. A központi útvonal, mely szerepet játszott számos flavonoid gyulladást csökkentő hatásában, az az NF-κB (nuclear factor-κB) jelképzés gátlása volt.82–84 Azonban más mechanizmusokat is megfigyeltek bizonyxos flavonoidoknál, például a hexamer procianidinok (nagy koncentrációban találhatók kakaóban, teában, almában) gátolják a tumor nekrózis faktor-α receptorhoz kötődését, s így a gyulladás-aktivációt sejt tenyészetben.86
Klinikai hatások
Folytonosan növekszik azoknak a laboratóriumi tanulmányoknak és randomizált vizsgálatokanak a száma, melyek a flavonoidokban gazdag étrend (kakaó, tea, bogyós gyümölcsök) jótékony kardiometabolikus hatását támasztják alá. A flavonoidokban gazdag kakaó termékek fogyasztása kicsi, de mérhető előnyt fejtenek ki a vérnyomásra, az endotél működésre, az inzulin rezisztenciára és a vér lipid szintekre.87–89 Egy 42 tanulmányt átfogó szisztémás beszámoló és meta-analízis szerint88 a csokoládé, a kakaó és a flavan-3-ol szignifikánsan csökkenti az artériás középnyomást (−1.64 Hgmm; 95% confidence interval [CI], −3.27 – −0.01 mm Hg), javítja az áramlás-közvetítette dilatációt (1.34%; 95% CI, 1%–1.68%), csökkenti HOMA-IR értékét (homeostatic model assessment for insulin resistance; −0.67; 95% CI, −0.98 – −0.36), és kis mértékben javítja az LDL-C (low-density lipoprotein cholesterol) valamint a HDL-C (high-density lipoprotein cholesterol) szintet (−0.07 ill. +0.03 mmol/L). A vérnyomáscsökkentő hatás már napi 6.3 g fekete csoki fogyasztása mellett megfigyelhető (ez kb. ≈30 kcal, azaz ≈1.5% napi energiabevitel többletet jelent).90 Ez az előny úgy látszik, hogy a javult endotél NO-termeléssel függ össze,90 ami egy alapvető fontosságú folyamat az ér- és metabolikus egészségének eléréséhez, s így további előnyt jelent a vérnyomás csökkentő hatáson túl. Egyre több adat utal arra, hogy a zöld vagy fekete tea csökkenti a vérnyomást, határértéken lévő vagy magas vérnyomású egyénekben, ahogy ezt egy 10 tanulmányt összefogó meta-analízis állítja, mely szerint a szisztolés nyomás 2,36 Hgmm-rel, a diasztolés nyomás 1,77 Hgmm-rel csökkent, bár ezeket a tanulmányokat az elégtelen információ szolgáltatás miatt nem lehetett teljesen értékelni .91 Egy bogyós gyümölcsök fogyasztásával foglalkozó, 22 randomizált, kontrollált tanulmányt összefogó szisztémás beszámoló és meta-analízis a szisztolés vérnyomás mérsékelt javulását (−2.72 Hgmm; 95% CI, −5.32 to −0.12), a glikémiás kontroll kismértékű javulását (HbA1C [hemoglobin A1C], −0.20%), a BMI (body mass index) csökkenését (−0.36 kg/m2), az LDL-C csökkenését (−0.21 mmol/L), és a gyulladásos biomarkerek (tumor necrosis factor-α, −1 pg/mL) csökkenését mutatta ki.92 Az itt említett legtöbb randomizált, kontrollált vizsgálat azonban kisméretű volt és időtartama is rövidnek (<6 months) bizonyult. Obszervációs tanulmányok is megfigyelték, hogy a táplálékkal bevitt flavonoidok és a flavonoidokban gazdag étrend csökkentik a kardiometabolikus események rizikóját.93–99 Például egy >90 000 középkorú ápolónőt 18 éven keresztül vizsgáló tanulmány szerint a becsült antocianin-bevitel szerint a felső kvintilisbe eső egyének csoportjában 32%-kal (95% CI, 4%–51%; P=0.03) alacsonyabb volt a miokardiális infarktus előfordulásának gyakorisága az alsó kvintilisbe esőkéhez képest; más alcsoportba tartozó flavonoidok (flavanonok, flavan-3-ol-ok, flavonolok, flavonok és flavonoid polimerek) és az össz-flavonoid-bevitelt vizsgálva nem találtak összefüggést a miokardiális infarktus előfordulásában.94 Alcsoport specifikus összefüggést figyeltek meg más populáció-alapú kohorsz tanulmányban: a flavanonok és az ischemiás stroke,95,96 valamint a flavonolok és a 2 típusú diabetes mellitus között.93 Ezek az eredmények a különböző flavonoidok eltérő hatására világítanak rá az egyes speciális kardiometabolikus kimentel vonatkozásában. Az étrenddel bevitt flavonoidok mennyiségének becslése jelentős hibát rejt magába, részben az önértékelés, részben az ételösszetevőket becslő táblázatok pontatlansága miatt.100 A vizelet és vér flavonoid biomarker tartalom vizsgálata jó kiegészítés lenne, de ezt eddig csak kevés hosszú-távú tanulmányban alkalmazták. Ezek a tanulmányok elsősorban izoflavonokkal és 2 típusú diabétesszel foglalkoztak és mérsékelt, fordított összefüggést mutattak ki a szója alapú ételekben található daidzein és genistein fogyasztással kapcsolatban.101 Az egyéb flavonoid biomarkerek és kardiometabolikus betegséggek összefüggéseivel foglalkozó adat kevés és ellentmondásos.102–105 További, nagy mintaméretet vizsgáló, populációs szintű, az eltzérő demográfiai sajátságokat és étrendi szokásokat is figyelembe vevő tanulmányokra lenne szükség.
Az egyéb fenolos vegyületekben (pl. fenolos savak és lignánok) gazdag olajos magvak és az extraszűz olivaolaj jótékony kardiomaetabolikus hatására is bizonyítékok igazolódtak. A PREDIMED tanulmány (PREvencion con DIeta MEDiterranea) során magas kardiovaszkuláris betegség (CVD) rizikóval sújtott résztvevőket vizsgáltak, randomizáltan mediterrán diétában részesítve a pácienseket, és napontai extraszűz olivaolajat vagya keverten olajos magvakat (dió, mogyoró, mandula) kaptak. A kontroll diétán lévőkkel (akiknek csökkent zsírbevitelt javasoltak) összehasonlítva az intervenciós étrenden tartottak csoporjában a CVD rizikó-profil (LDL-C, vérnyomás, gyulladásos biomarkerek) javult106–108 és ez ≈30%-kal alacsonyabb mortalitási, infarktus- vagy stroke-rizikót jelentett.109 Az intervenciós csoportba soroltaknál kisebb mértékűnek adódott a centrális hízás és csökkent a testsúly a ≈5 éves nyomon követés során.110 Prospektív kohorsz tanulmányokat átfogó meta-analízis is a magasabb olajos mag fogyasztás kardiometabolikus előnyét támasztotta alá: napi minden 1 oz (28 g) bevitel, ≈30%-kal csökkentette a szív koszorúér betegség (CHD) kockázatát (n=11 tanulmány; relatív rizikó=0.71; 95% CI, 0.63–0.80) and 39%kal csökkent a diabetes mellitus rizikója (n=4 tanulmány; relatív rizikó=0.61; 95% CI, 0.43–0.88).111
Összefoglalva: egyre több adat támasztja alá a flavonoidokban és más fenolos vegyületekben gazdag étrend jótékony kardiometabolikus hatását. Ezek az adatok alátámasztják azt a javaslatot, hogy ezeknek a komponenseknek a fogyasztását fokozni tanácsos és ösztönzik további mechanisztikus és prospektív kohorsz tanulmányok és klinikai vizsgálatok végzését, hogy jobban lehessen jellemezni az egyes vesgületek hatását és a dózis-hatás összefüggésket.
Tejtermékek
A tejtermékek a kaloriabevitel ≈10%-át fedezik az Egyesült Államokban megszokott étrendet figyelembe véve.112 Annak ellenére, hogy ezeket az ételeket jelentős mennyiségben fogyasztják, kevés tanulmány született, mely a tejtermékek fogyasztásának közvetlen egészségre gyakorolt hatását vizsgálja. A tejtermékekre vonatkozó hagyományos étrendi javaslatok főként elméleti megfontolásokon alapulnak és speciális összetevőkre vonatkoznak, (pl. egyen naponta háromszor ilyen termékeket, hogy az egészséges csontokhoz szükséges kalcium és D-vitamin mennyiséget fedezze; fogyasszon alacsony zsírtartalmú ternékeket, hogy csökkentse a kalóriabevitelt és a súlygyarapodást és redukálja a telítet zsírok bevitelét a szívbetegségek megelőzése érdekében),113 és nem azokon az ereményeken, mely a tej, sajt, joghurt, vaj és más tejtermék fogyasztás hatását klinikai és mechanisztikus vizsgálatokkal támasztják alá. Növekvő mennyiségű bizonyíték utal arra, hogy a tejtermékek komplex kardiometabolikus hatással rendelkeznek, mely a táplálék komponensek egymásra hatásán és egyéb jellegzetességén (probiotikumok, fermentáció és homogenizáció) alapul (2. ábra). Az alábbiakban nem foglalkozunk a D- vitamin szerepével, ezzel kiterjedt irodalom foglalkozik.114,115
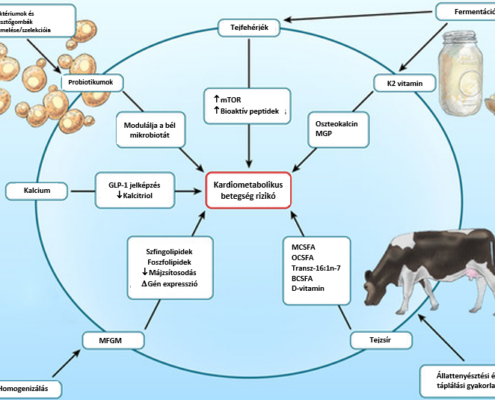
2.ábra: A tejtermékek fontos tulajdonságai és a kardiometabolikus betegségrizikóval összefüggésbe hozható egyes molekuláris folyamatok. A terjtermékek jellegzetessége, hogy tápanyagok komplex keverékéből áll és a szív-érrendszerre és a metabolikus folyamatokra gyakorolt hatása feldolgozásának módszreitől is függ. A sajátos zsírsav- összetétel, a kalcium, a probiotikumok a fő összetevői közé tartoznak. A fő előállítási folyamatok közé tartoznak az állettenyésztési és táplálási eljárások, a fermentáció, a megfelelő baktérium és élesztőgomba törzsek kiválasztása és tenyésztése (a fermentáció beindításához) és a homogenizáció. Ezek a módosítások megvátoztathatják az élelmiszer összetéttelét (pl. a fermentáció hatására K1 vitaminból K2 vitamin képződik) és a termék lipidstruktúráját (pl. a homogenizáció károsítja az MFGM-t), és ezek a változások befolyásolhatják a molekuláris és jelképző folyamatokat.
BCSFA: elágazó láncú telített zsírsavak (branched-chain saturated faty acids); GLP-1: glucagon-like peptide 1; MCSFA: közepes láncú telített zsírsavak (medium-chain saturated fatty acids); MFGM: tejzsír globuláris membránok (milk-fat globule membranes); MGP: matrix glutamate protein; mTOR: mammalian target of rapamycin; OCSFA: páratlan láncú telített zsírsavak (odd-chain saturated fatty acids). (Illusztráció: Ben Smith.)
K alcium
Sejtkultúrát és állatokat alkalmazó kísérletekben önmagában vagy egyéb tejtermék komponensekkel együtt elemezték a kalcium és a kardiometabolikus rizikó kapcsolatát. Több elhízást vizsgáló állatmodellben a kalciumpótlás csökkentette a testsúly gyarapodást, enyhítette a májzsírosodást, mérsékelte a magas vércukorszintet és az inzulin rezisztenciát.116–119 Ezeket a hatásokat a leptin és GLP-1 jelképzés korrekcióján keresztül fejtette ki,118,120 redukálta a kalcitriol (1,25-dihidroxi-D3-vitamin) szintet, gátolta a májban és a zsírszövetben a lipogenezist121,122 és megváltoztatta a bélben a mikrobiota összetételt.123,124 Más állatmodellekben azonban nem lehetett ilyen jótékony hatását kimutatni.125–127 Étel-induklálta elhízásos egérmodelben például a kalcium adagolás súlygyarapodást okozott a kontrollcsoporthoz képest.127 Egy 20 tanulmányt áttekintő meta-analízis szerint, mely összesen 2711 résztvevő adatait értékelte, a kalcium-pótlás nem csökkentette szignifikánsan a testsúlyt (−0.17 kg, 95% CI, −0.70 to 0.37) vagy a test zsírt (−0.19 kg; 95% CI, −0.51 to 0.13).128 Ezzel összevetve a tejtermékek növelik a zsírmentes testtömeget, csökkentik a test zsírtartalmát testsúlycsökkentést célzó energiakorlátozást okozó étrend mellett, a kontroll csoporttal összehasonlítva (ld. a Klinikai hatások részben, lejjebb), arra utalva, hogy ebben a kalciumon túl egyéb komponens is szerepet játszhat.
Embereken végzett rövid-távú vizsgálatokban a kalcium pótlás mérsékelten csökkentette a vérnyomást, az átlagkülönbség (és annak 95%-os konfidencia intervalluma) a következőképpen alakult: a szisztolés vérnyomásra −1.43 Hgmm (−2.15 to −0.72 Hgmm; I2=0%) és a diasztolés vérnyomásra −0.98 Hgmm (−1.46 to −0.50 Hgmm; I2=49%).129 Egyes hipertenziós állatmodellekben a kalciumpótlást követő vérnyomáscsökkenéshez számos tényező járult hozzá: mind az endotél-függő, mind az endotél független artéria relaxáció, az ér-simaizom megnövekedett hiperpolarizációja, a fokozott nátrium-kiválasztás, a vese angiotenzin-konvertáló enzimjének down-regulációja.130–133 Azt azonban, hogy a kalciumbevvitel emberben hasonlóan hat az említett folyamatokra, nem tisztázták. Azt találták hosszú-távú randomizált vizsgálatok meta-analízise során, hogy a kalciumpótlás mérsékelten emelkedett szívizom infarktus rizikó trendet eredményez.134,135 Mao és munkatársainak tanulmánya szerint135 a kalcium-pótlásban részesülteket a kontroll csoporttal összehasonlítva az esélyhányados (95% CI) 1.28 (0.97–1.68; P=0.08; I2=0%) értéket adott. A magasabb kalciumszinttel összefüggő genetikai variánsokban is a miokardiális infarktus és szív koszorúér betegség rizikó fokozottnak bizonyult a mendeli rqandomizációs tanulmányokban.136 Arra a hipotézisre következtettek, hogy a fokozott rizikó a táplálkozás után hiperkelcémiával áll összefüggésben, melyet a pótlás okozott (az ételből történt felvétellel összehasonlítva), s ez a erek kalcifikációjához járulhat hozzá. Összességében, a kalcium a tejtermékek jótékony kardiometabolikus hatásához nem járul hozzá meggyőzően, bár hatásai attól is függnek, hogy közvetlen pótlást, vagy megfelelő élelmiszerforrást alkalmaznak a bevitelhez.
Tejtermék fehérjék
A tehéntej ≈32–34 g/L koncentrációban tartalmaz fehérjét, főként kazeint (ez csapódik ki aludttej készítése során; a tejfehérjék ≈80%-át ez képezi) és tejsavó fehérjét (≈20%).137 Mind a kazein, mind a terjsavó fehérje számos kisebb, aminosav összetételben különböző fehérje frakcióból áll.137 Néhány állatkísérletben, a kazeinben, savófehérjében vagy teljes tejfehérjében gazdag étrend javította a glukóz-inzulin és kardiometabolikus rizikótényezőket.138–140 Ez a jótékony hatás az említett fehérjék sajátos aminosav összetételével lehetnek kapcsolatban. A savófehérjék például elágazó láncú aminosavakban (leucin, izoleucin, valin) gazdagok, melyek fontos jelátviteli útvonalakat aktiválnak, mint az mTOR (mammalian target of rapamycin) és a silent information regulator transcript 1,141,142 s ezek fokozott termogenezist és inzulin-elválasztást okoznak.143 Az elágazó aminosav adagolás azonban állatkísérletekben a metabolikus kiementel tekintetében változó eredményhez vezettek.144–147 Aránylag kevés kontrollált tanulmányt végeztek emberen intakt tejfehérje izolátumokkal.148 Számos kazeinből származó lakto-tripeptidre összpotosított vizsgálatban szignifikáns szisztolés (átlag különbség: −2.95 Hgmm; 95% CI, −4.17 to −1.73 Hgmm) és diasztolés (átlag különbség: −1.51 Hgmm; 95% CI, −2.21 to −0.8 Hgmm) vérnyomás csökkentést állapítottak meg, a tanulmányok eredményeit közösen vizsgálva, bár ezeket óvatosan kellene értékelni a publikációs eltérések és a jelentős heterogenitás miatt.149 Más rövid-távú (≤12 hét) értékelte a tejfehérjék glukóz-inzulin homeosztázisra gyakorolt hatását: összességében kedvező hatást mutattak ki, de hosszú-távú tanulmány kevés született.137
Tejfhérjékből származó bioaktív peptidek hozzájárulhatnak a hatásokhoz. Ezek fermentáció során (pl. sajtban, kefírben, aludttejben) keletkeznek baktériumok proteolitikus enzimjei hatására vagy a gyomor-bélrendszerben alakulnak ki az emésztés során (a mikrobiotához kapcsolt metabolizmust is beleértve).150 Számos (3-4 aminosav hosszúságú) kazeinből és savófehérjéből származó peptidről bebizonyosodott, hogy az angiotanzin-konvertáló enzimre gátló hatást fejt ki in vitro.151 Más tejtermékből származó peptid mérsékelt diperptidil-peptidáz-4 aktivitás gátló hatását igazolták,152,153 mely hozzájárulhat az inkretin hormonok (gastric inhibitory peptide és glucagon-like peptide-1) megnövekedett élettartamához és ezzel a megjavult glikémiás kontrollhoz.143 Másrészt ilyen, tejtermékekből származó peptidek jelentősége kérdéses, alacsony biológiai hozzáférhetőségük miatt; a keringésben koncentrációjuk pmol/l – nmol/l koncentrációban található.154
Összességében a kísérletes és rövid-távú humán metabolikus tanulmányok a tejtermék fehérjék jótékony kardiometabolikus hatását támasztják alá, de a kazein/ savófehérje hatásossága, az egyes aminosavak/ peptid metabolitok és a velük kapcsolatos molekuláris mechanizmusok, fontos folyamatok hatása alultanulmányozott.
Tejtermék zsírok
A diétás irányvonalak általában alacsony zsírtartalmú/zsírmentes tejtermék fogyasztását javasolják, arra hivatkozva, hogy a telített zsírsavak, a mirisztinsav (14:0) és a sztearinsav (16:0) emeli az LDL-szintet, ugyanakkor ezen zsírsavak VLDL-re, remnant chylomikronra, HDL-koleszterinre gyakorolt kedvező hatását alulértékelik,155 kevesebb figyelmet fordítanak a tejzsír nagyobb részét képező sok másik zsírsav lehetséges egészségügyi hatásaira (pl. a 14:0 és a 16:0 a totál zsírsavtartalom ≤40%-át teszi ki a tehén-, juh- és kecsketejben).156 Ezek közé tartoznak a közepes láncú telített zsírsavak (medium-chain saturated fatty acid – MCSFA, 6:0, 8:0, 10:0, 12:0), a páratlan szénatomsszámú telített zsírsavak (odd-chain saturated fatty acids – OCSFA, 15:0, 17:0), az egyszeresen és többszörösen telítetlen zsírsavak (monounsaturated and polyunsaturated fatty acids – MUFA, PUFA, 18:1n-9, 18:2n-6, és 18:3n-3), az elágazó láncú telített zsírsavak (branched-chain saturated fatty acids, BCSFA), és a nyomokban található természetes (rumináns) transz- zsírsavak (eg, transzpalmitolajsav – transz-16:1n-7).156–158 A tejtermék zsírok foszfolipidek (tejzsír-globuláris membrán – milk fat globule membrane – MFGM) és zsírban oldódó vitaminok (D, K, és K2) forrásai is (melyek a fermentáció során keletkeznek, ld. alább).
Az MCSFA-k, melyek a tej zsírsavak ≈6% – 17%-át alkotják, más molekuláris és metabolikus aktivitással rendelkeznek, mint a hosszabb láncú zsírsavak. Míg a hosszabb láncú telített (16:0 and 18:0) zsírok például aktiválják az NF-κB-t és csökkentik az inzulinérzékenységet vázizomsejt kultúrában, az MCSFA (8:0, 10:0, 12:0) nem.159 Az MCSFA a mitokondriumok oxidatív kapacitását is fokozza és csökkenti a tenyészetben lévő izomsejtekbe a lipid-beépülést a 16:0 zsírsavhoz képest.160 Ezek a hatások érthetővé teszik a zsír-beépülés és az inzulin rezisztencia csökkenését MCSFA –táplált állatokban, ha ezt hosszabb láncú zsírsavval táplált kontrollokkal hasonlítjuk össze.160,161 Ezzel ellentétben, ha alacsony zsírtartalmú étrenden tartott és nagymennyiségű MCSFA-val táplált állatokat hasonlítunk össze, utóbbiakban hepatikus de novo lipogenezis, triglicerid beépülés volt látható és csökkent a máj inzulinérzékenysége.161,162 A máj lipogenezis indukció az MCSFA máj X-receptor-a aktivációt és jelképzést okozó hatásával magyarázható.163 Megjegyezendő, hogy sok megelőző MCSFA hatás elemzésekor obez állatmodellt alkalmaztak és gyümölcsből (kókusz) származó zsírok hatását vizsgálták, és így a tejtermékekből származó MCSFA eukalorikus körülmények közötti metabolikus hatásaira nem derült fény.
A transz-16:1n-7, az elágazó láncú telített zsírok és a páratlan szénatomszámú telített zsírok biológiai hatásaia kevés figyelmet kaptak. Azt a hipotézist állították fel,164 hogy az étrendi transz-16:1n-7 hatása hasonló, mint a diétás cisz-16:1n-7-é, amely mikor táplálékban fogyasztják vagy a májon kívül termelődik, úgy látszik, hogy negatív feedback-en keresztül gátolja a máj de novo lipogenezisét, javítja az inzulinérzékenységet és csökkenti a gyulladást,165–169 összhangban egy rizikótényező javulást igazoló humán vizsgálattal.170 INS-1 β sejtek tenyészetében a transz-16:1n-7 kezelés a PPAR-γ-t és a transzkripciós faktor PDX-1-t (pancreatic duodenal homeobox-1) aktiválta.171 A jelentősége ezeknek a hatásoknak a glukóz-inzulin homeosztázisra és más trans-16:1n-7 molekuláris megnyilvánulásra, egyenlőre ismeretlen maradt. Az elágazó láncú telített zsírsavakat is alig értékelték. A 15-metil-hexadekánsav (ami egy BCSFA) hasonló hatást fejtett ki a PPAR-g-ra és a PDX-1-re, mint a transz-16:1n-7 az INS-1 β-sejt-tenyészetben alapállapotban és ezen felül ellenállás mutatkozott a magas glukóz okozta PDX-1 szuppresszióval szemben.171 A főként tejtermékből és marhahúsból származó elágazó szénláncú telített zsírsav bevitel nem elhanyagolható az Egyesült Államokban (a becsült napi mennyiség ≈500 mg),158 összehasonlítva a 125 és 160 mg/d közötti tenger gyümölcseiből származó hosszú-láncú n-3 többszörösen telítetlen zsírsav bevitellel.172 Ezek az adatok alátámasztják a BCSFA bevitel mennyiségének jelentőségét és nagy szükség lenne ezek biológiai hatásainak további elemzésére. A páratlan szénatomszámú zsírsavak számos szövetbe beépülnek (vér, máj, zsírszövet).173,174 Ezek energiaforrásként szolgálank a β-oxidáción keresztül, és egyéb metabolikus funkciót is betöltenek, mint a citromsavkör újratöltését és a mitokondriumok működés javítását,174 de ezeket a feltételezéseket szigorúan ellenőrzött kísérletekben vizsgálni kellene.
Tejzsír globuláris membrán
A tejzsírt a természetben a tejzsír globuláris membrán (milk fat globule membrane, MFGM) köti meg, mely egy poláros lipidekben (foszfolipidek, szfingolipidek) és fehérjékben gazdag háromrétegű membrán, és ebben foglal helyet a globuláris triglicerid mag.175 Az MFGM-ben található poláris lipidek és fehérjék bioaktív hatással rendelkeznek. Egerekben szfingolipid és tehéntej foszfolipid adagolás csökkentette a szérum koleszterin szintet és a májban történő lipidfelhamozódást, hozzájárult a csökkent intesztinális koleszterinfelvételhez és megváltoztatta a hepatikus gén-expressziót.176–178 Gyulladáscsökkentő hatásuk lehetőségéről is beszámoltak – MFGM-ben gazdag étrenden tartott egerekben mérséklődött a szisztémás lipopoliszacharid terhelésre adott gyulladásos válasz, feltehetőleg a bélpermeabilitás csökkenés miatt.179 A tejfeldolgozásd megváltoztathatja az MFGM mennyiségét és szerkezetét – például a homogenizálás károsíthatja az MFGM-t.180 Egy új, 57 túlsúlyos felnőttet vizsgáló tanulmányban az MFGM hatását vizsgálták a vérlipid szintekre és a génexpresszióra. A kaloriabevitel ≈15%-át tejszínhab (intakt MFGM) vagy vaj (kevés MFGM a homogenizáció miatt) képezte, másban a tejzsír és telített zsírsav tartalom megegyezett. Nyolc hét után az LDL-koleszterin és az ApoB/AI arány emelkedett, míg a habtejszínt fogyasztók körében a lipidprofil változatlan maradt.180 A tejszínhabot kapó csoportban a perifériás vér monomukleáris sejtjeiben szignifikánsan csökkent 19 gén expressziója, többek között az USP45, MDM2, SNRPN, és a CAPZA1, alátámasztva ezzel az MFGM génexpresszióra kifejtett hatását. Hasonló, LDL-C koncentrációt csökkentő hatást láttak cross-over tanulmányokban, melyekben sajt és vaj vagy nem tejtermék telített zsírok hatását hasonlították össze (ld lejjebb, Klinikai hatások részben).181,182 Ezek az eredmények arra utalnak, hogy a feldolgozási módszerek, melyek megvédik vagy tönkreteszik az MFGM-t jelentősek lehetnek abban, hogy tejtermék milyen kardiometabolikus hatást fejt ki.
Probiotikumok
Egyre több bizonyíték támasztja alá az élelmiszerekben lévő probiotikumok egészségre gyakorolt hatását. Az élő mikroorganizmusok megváltoztathatják az étel sajátosságait és a gazdaszervezet válaszát fogyasztásukat követően.183 Mind a joghurt, mind a kefir gyakran élő baktériumokat tartalmaz (a kefir élesztőgombákat is tartalmazhat). Számos elhízást és diabéteszt modellező állatkísérletben a probiotikukat tartalmazó tejtermékek jótékony kardiometabolikus hatást fejtettek ki a probiotikumokat nem tartalmazó készítményekkel. Például magas kalória-/zsírbevitellel táplált C57BL/6 egerekben, ha az állatokat kefírrel etették, csökkent a súlygyarapodás, a májzsírosodás, az LDL-C és IL-6 szint a nemfermentált tejjel etetett állatokhoz képest.184 Ezeket a változásokat a máj- és a zsírszövetben azon gének megváltozott expressziója kísérte, melyek a zsírsav-oxidációval (AOX, PPAR-α) és a gyulladással (MCP-1) kapcsolatosak. Más tanulmányok azt sejtetik, hogy a hatás probiotikum specifikus: pl. nem fermentált tejet különböző Lactobacillus rhamnosus törzseket tartalmazó tejtermékkel összeasonlítva különböző mértékben javult a glukóz tolerancia és az éhezési cukorszint diabéteszes patkánymodellben.185 A probiotikumok egészségre gyakorolt hatásának molekuláris mechanizmusa a gazdaszervezet bél mikrobiotája összetételének és működésének megváltozásához kapcsolódik.186 Például a mikrobiota összetételét az állatokban olyan probiotikus tejtermékekkel változtatták, mint a joghurt vagy a kefir.184,187,188 Ezek az összetételbeli változások erősíthetik a bél felszívóhám integritását és csökkenthetik az endotoxaemia miatti alacsony szintű gyulladást. Úgy tartják, hogy az az elhízással összefüggő betegségekhez a bél mikrobiotából származó lipopoliszacharidok keringésbe jutása járul hozzá.189 A probiotikumok befolyásolják a gazdaszervezet mikrobiota működését, például megváltoztatják annak funkcionális mediátor termelését. Ilyen pl. az SCFA, mely a gazdaszervezet metabolizmusára mind helyi, mind szisztémás szinten hatással van.190,191 Összegezve, állatkísérletes tanulmányok és humán vizsgálatok alátámasztják a a probiotikumok és a probiotikum-mikrobiota interakciók súlygyarapodás, elhízás és az azzal összefüggő metabolikus állapotok (mint a gesztációs diabétesz) elleni védő szerepét.192–203
Sajtok, fermentáció és a K-vitamin
A K-vitaminnak két fő formája ismert: a zöld leveles zöldségekben és bizonyos növényi olajokban bőséggel előforduló K1- vitamin (fillokinon) és az izoprén-csoportok számában különböző K2-vitamin (menakinon? MKn). Az ipari tejfermentációhoz és sajtkészítéséhez leggyakrabban használt baktériumfajok K2 vitamint termelnek, s így a K2-vitamin (főként az MK-7, -8 és -9) fő forrásai Európában és Észak-Amerikában.204,205
A K-vitamin összes formája kofaktor a fehérjék glutaminsav csoporjainak g-karboxilációjához, mely a K-vitamin-függő fehérjéket aktiválja. Bár a VII, IX és X alvadási faktor jólismert K-vitamin-függő fehérje, egyre bizonyossabbá válik, hogy a K-vitamin-függő fehérjék hatással vannak a kardiometabolikus egészségre.204 Ezen proteinek közé tartozik az oszteokalcin (ami a csontsejtekben termelődik) és a mátrix-glutamát-protein (MGP, mely főként az erek simaizomsejtjeiben és a porcokban termelődik). Állatkísérletek támasztják alá az oszteokalcin szerepét a b-sejt proliferáció javításában, az inzulin expresszióban és a zsírsejtekben történő adiponektin up-regulációban.206 Számos metabolikus tanulmányban a K-vitamin pótlás fokozta a karboxilált oszteokalcn mennyiségét és csökkentette az inzulinrezisztenciát.207,208 Azonban nem minden humán tanulmány végződött ezzel az eredménynel,209 és ellentétes irányú összefüggést is megfigyeltek az oszteokalcin karboxilált/dekarboxilált formája és az inzulinszenzitivitás között attól függően, hogy a vizsgálat egereken vagy embereken, s ez a bizonyos species különbségekre utal.210 A glukóz-inzulin homeosztázis javulásához szükséges K-vitamin mennyiség és g-karboxilált oszteokalcin arány tisztázatlan maradt.211 Hasonlóképpen, bár az a hipotézis született, hogy a K-vitamin csökkentheti a CVD rizikót az erek kalcifikációját gátló MGP növelésével, jelenleg ezt mét nem bizonyították meggyőzően. Számos patkány- és egértanulmányban a K-vitamin csökkentette az erek kalcifikációját, de hogy ez a K-vitamin MPG-t karboxiláló hatásával volt-e összefüggésben, tisztázatlan maradt.212–214
Humán metabolikus tanulmányk kimutatták, hogy bizonyos K2-vitamin típusok élettartama hosszabb, mint a K1-vitaminé és magasabb szintet érnek el a keringésben annál. Például, míg a K1-vitamin féléletideje 1-2 óra, addig az MK-7 és MK-9-é 2-3 nap.215,216 Ezeknek a biológiai hozzáférhetőségben meglévő különbségeknek funkcionális következményei lehetnek – egy egészséges felnőtteken végzett tanulmány szerint MK-7-tel végzett pótlás az oszteokalcin teljesebb karboxilációját eredményezte.216 Ezen eredmények alapján arra lehet következtetni, hogy a (nyugati étredben a totál étrendi K-vitamin ≈15% – 20% -át kitevő) K2 vegyületek és a maradék arányt képviselő K1 vitamin aránytalanul járulnak hozzá a K-vitamin aktivitáshoz in vivo.205 Újabban újabb kohorsz tanulmányok arra utalnak, hogy a K2 és nem a K1 áll összefüggésban a csökkent CHD.217–219 Például egy 16 057 49-70 év közötti nőn végzett prospektív kohorsz tanulmány szerint a CHD 10mg/nap K2-vitamin bevitelenként (ami ≈1 SD-nek felel meg) 0.91 (95% CI, 0.81–1.00; P=0.04) a hazárd ráta, ugyanakkor K1 bevitel nem jelentett változást a CHD rizikóban.219 Ezeket az eredményeket és a fermentált tejtermékekkel és satokkal kapcvsolatos klinikai kimenetli tanulmányokat figyelembe véve, a fermentációnak és a K2-vitaminnak jelentős szerepe van a kardiometabolikue egészségben, s ez egy ígéretes terület a további tudományos kutatásokhoz.
Klinikai hatások
Rövid-távú randomizált vizsgálatokban a tej és az összes tejtermékfogyasztás emelte aq zsírmentes testtömeget és csökkentette a testzsírt, főként az energiakorlátozó, testsúlycsökkentésre irányuló diéta esetén.128,220,221 A hosszú-távú hatás kevésbé tisztázott, és függhet a tejtermék típusától. Megjegyzésképpen, számos tanulmány azt sugallja, hogy a több alacsony zsírtartalmú tejet fogyasztó gyermekek súlygyarapodása kifejezettebb, mint azoké, akik teljes zsírtartalmú tejet fogyasztottak nagyobb mennyiségben.222–226 Csak kevés hosszú-tavú vizsgálat született gyermekekben, sazok multikomponensű étrendi változtatásokon alapultak, így eleve kizárták, hogy maguknak a tejtermékeknek tudják értékelni a hatását.227,228
A tejtermék bevitel és a súly, a CVD, a diabetes mellitus kapcsolatával foglalkozó, felnőtteken végzett hosszú-távú tanulmányokban a végpont ételtípusok szerint (sajt, joghurt, tej és vaj) jobban változott, mint a zsírtartalom szerint.229–235 Sem az alacsony zsír-, sem a teljes zsírtartalmú tej bevitele nem függöt össze észerevehetően a súlygyarapodással,196,202,203 mely talán az enyhe kalóriakompenzációval volt magyarázható: amikor az emberek több zsírszegény tejtereméket ettek, fokozták átlagos szénhidrát fogyasztásukat, mikor több teljes tejterméket ettek, csökkentették az átlagos szénhidrát bevitelt.202 A sajtfogyasztás hatása szintén semlegesnek tűnik a hosszútávú súlygyarapodás tekintetében, bár ezt szénhidrátbevitellel módosítani lehetett: súlygyarapodás volt látható, mikor a sajtfogyasztást finomított szénhidrátbevitel kísérte, és viszonylagos súlycsökkenést észleletek, mikor a sajtot finomított szénhidrátra cserélték.202 A joghurt következetesen védő hatású a hosszú-távú súlygyarapodással szemben,196,202,203 még akkor is, ha cukorral édesítették (bár ebben az esetben csak a jótékony hatás fele látható, az édesítésmentes joghurttal szemben202).
Bár a tejtermékekből származó telített zsír bevitel várhatóan emeli az LDL-C-t,236 a jelenlegi randomizált kontrollált tanulmányok ilyen típusú hatások heterogenitását mutatják, a fogyasztott tejtermékek típusától függően. Példál 49 férfi és nő bevonásával végzett cros-over tanulmány szerint azonos mennyiségű zsírt és telített zsírt bevíve, csökkent a totál-, LDL- és HDL-koleszterin koncentráció, ha a zsír sajtból származott szemben azzal, ha az vajból lett bevíve.181 Hasonlóképpen enyhült a hatás a totál és LDL- koleszterin szintre egy randomizált, kontrollált, cross-over vizsgálatban, mikor a telített zsír tejből vagy sajtból származott, szemben azzal, mikor az nem tejtermékből származott,182 és hasonló különbség volt látható, mikor a telített zsír tejszínhabból származott szemben azzal mikor vajból vitték be.180 Ilyen heterogén válasz a tejtermékekben található egyéb komponensekkel (pl. kalcium) vagy az egyéb feldolgozási módszerrel (pl. MFGM megléte vagy hiánya, ld. feljebb) magyarázható.237 A telített zsírok ellensúlyozó, s úgyszintén jótékony hatása figyelhető meg a trigliceridben gazdag VLDL-re,236 ami megmagyarázhatja, hogy a hosszú-távú konorsz tanulmányok meta-analízise nem mutat szignifikáns összefüggést a teljes tejtermék bevitel és a CHD események között és valójában csökken a stroke rizikó, a csökkent és a szokásos zsírtartalmú termékek fogyasztásakor feltételezhető különbség nélkül.1
A tejtermék bevitel és a 2 típusú diabétesz kapcsolata szintén az étel típusa szerint változik: a joghurt (de a tej nem) fogyasztás következetesen alacsony rizikót jelent, továbbá a nagyobb kalória-, zsír- és telített zsírtartalmú sajt fogyasztás is alacsonyabb rizikóval párosul, bár nem minden tanulmányban.232,234,235,238,239 Ezeket a különbségeket részben megvilágítja, hogy eltérő összefüggés mutatkozik teljes tej (általában nincs kapcsolatban a diabétesz rizikóval) és a fermentált tejtermékek (csökkent rizikóval jár) fogyasztás között,234,238,240 a fermentált tejtermékek (mint a sajt) lehetséges jótékony metabolikus hatása miatt (ld. feljebb).
Érdekességképpen, maga a tejtermék zsír elősegítheti a kardiometabolikus egészséget. Objektív biomarkereket alkalmazó kohorsz tanulmányokban a tejtermék zsírsavak magasabb szintje következetesen csökkentette diabetes melitus incidenciáját 241–245 és talán csökkentette CHD rizikót,246–248 míg stroke vonatkozásában az eredmények eltérőek.249 Amint az előzőekben leírtuk, a megfigyelések mechanisztikus magyarázata tisztázatlan maradt, melynek oka a fermentált ételek (főként a sajtok, melyek a tejtermék zsírok fő forrásai) hatása és olyan biomarkerek jelenléte, mint az MFGM, a speciális zsírsavösszetétel (pl. elágazó láncú zsírsavak, MCSFA, és speciális rumináns transz zsírok), az egyéb lipidoldékony tényezők vagy ezeknek a vér biomarkereknek az ismeretlen, endogén (nem étrendi) maghatározói.250
Jövőbeli irányvonalak és következtetések
A modern táplálkozástudomány rávilágít az összetevők különbözőségére és azokra a mechanizmusokra, melyekkel az élelmiszerek az egészségeet befolyásolják. Számos in vitro és állatkísérletes tanulmány támasztja alá a flavonoidok több, kardiometabolikus betegséggel kapcsolatos rizikótényezőre és folyamatra gyakorolt pleiotrop hatását. Bár a molekuláris mechanizmusokat tovább szükséges tanulmányozni és azonosítani kell a jelátviteli útvonalakat (AMPK, PPAR-γ, PGC-1α, és NF-κB). A meglévő kísérleti tanulmányok módszertani hiányosságokat mutatnak, fennáll a publikációs eltérés lehetősége, és nem tisztázott az eredmények emberre történő alkalmazhatósága. Ezen felül több, mint 5000 természetben keletkező flavonoidot azonosítottak,251 néhány flavonoiddal kapcsolatban megfigyelt molekuláris folyamatok nem valószínű, hogy általánosan azonosíthatók az összes többire. A mechanisztikus tanulmányokból származó jelenlegi adatok a flavonoidok aglikonjára összpotosítanak és gyakran azokat szuprafiziológiás koncentrációban alkalmazták (pl. 25–100 μmol/L, míg a keringésben nem valószínű, hogy elérik a ≥10 µmol/L koncentrációt).21,252 Bár az eredmények szuprafiziológiás dózison alapulnak, ezek a flavonoidok farmakológiai bevezetését célozzák, de így kevéssé alkalmazható a táplálkozással bevitt flavonoidok hatásának megítélésére. A megelőző kísérletesd tanulmányok továbbá általában nem adnak számot a flavonoid metabolizmus és biológiai hozzáférhetőség összetettségéről. Például a legtöbb étellel bevitt flavonoid (a flavan-3-ol kivételével) glikozidos formában található, egy vagy több cukor-csoporthoz kötötten,7 melynek általában hidrolizálódnia kell, mielőtt felszívódik a bélből.8 Felszívódásukat követően a flavonoidok I-fázisú és II-fázisú metabolizmuson mennek át és különböző glukuronidált, szulfatált és metilált metabolitokká alakulnak.64 A fel nem szívódott flavonoidokat a vstagbél baktériumai katabolizálják, főként sokféle fenolos savakká. Az eredeti molekulával hasonlítva sok metabolit élettartama hosszabb és magasabb konentrációt ér el a keringésben.22 Az állatkísérletekben észlelt kardiometabolikus hatásokhoz inkább a metabolitok járulnak hozzá és nem a metabolizmus előtti flavonoid. Aránylag kevés vizsgálat értékelte a flavonoid metabolitok hatását, melyet jelentős részben a szintetikus standardok hozzáférhetőségének hiánya korlátozott.20,22 Mivel ezen a vegyületek élettani hatása ígéretes, a jövőben mechanisztikus, kísérletes és klinikai tanulmányokra lesz szükség, melyek figyelembe veszik a flavonoidok sokféle típusát és azok biológiai hozzáférhetőségét, metabolizmusát, metabolitjait, hogy jobban megérthessük a klinikai jótékony hatást kifejtő legmegfelelőbb formáikat és átalakulásaikat.
Hasonlóképpen, úgy tűnik, hogy a tejtermékek különböző összetevőik és feldolgozási módszereik szerint fejtik ki hatásukat a kardiometabolikus egészségre. A potenciálisan releváns összetevők a speciális aminosavak, a középláncú és páratlan láncú telített zsírsavak, a telítetlen zsírsavak, az elágazó láncú zsírsavak, a természetes transz zsírok, a probiotikumok, a K1/K2- vitamin, és a kalcium, továbbá a feldolgozási technikák, mint a fermentáció és homogenizáció is befolyásolja hatásukat. Az mTOR-, SIRT-1-, ACE-, PPAR-, oszteokalcin-, MGP-közvetítette folyamatok, a de novo hepatikus lipogenezisre, a máj- és zsírszövetben végbemenő zsírsav-oxidációra és gyulladásra kifejtett hatás, továbbá a bél mikrobiommal történő kölcsönhatás (intesztinalis integritás és endotoxaemia) járul hozzá az észlelt változásokhoz.
Mind a flavonidok, mind a tejtermékek esetén a folyamatok és válaszok sokfélesége jelentékeny. Ezek az új adatok megvilágíják, hogy ismereteink jelentősen bővültek és azt is, hogy mi az amit meg kell még tanulnunk arról, hogy a különböző étrendi tényezők hogyan befolyásolják az egészséget. Tekintettel arra, hogy a kardiometabolikus és metabolikus egészségre kifejtett hatás a táplálkozás fő jelentősége, az eddigi eredmények alátámasztják, hogy ezen élemiszerek releváns összetevőinek, biológiai folyamatainak és klinikai hatásainak további alapos elemzésére van szükség.
Irodalom
1.Mozaffarian D. Dietary and policy priorities for cardiovascular disease, diabetes, and obesity: a comprehensive review. Circulation. 2016; 133:187–225. doi: 10.1161/CIRCULATIONAHA.115.018585. LinkGoogle Scholar
2.Micha R, Peñalvo JL, Cudhea F, Imamura F, Rehm CD, Mozaffarian D. Association between dietary factors and mortality from heart disease, stroke, and type 2 diabetes in the United States. JAMA. 2017; 317:912–924. doi: 10.1001/jama.2017.0947. CrossrefMedlineGoogle Scholar
3.Bloom D, Cafiero E, Jané-Llopis E, Abrahams-Gessel S, Bloom L, Fathima S, Feigl A, Gaziano T, Mowafi M, Pandya A, Prettner K, Rosenberg L, Seligman B, Stein A, Weinstein C. The Global Economic Burden of Noncommunicable Diseases. Geneva, Switzerland: World Economic Forum; 2011. Google Scholar
4.Cassidy A, O’Reilly ÉJ, Kay C, Sampson L, Franz M, Forman JP, Curhan G, Rimm EB. Habitual intake of flavonoid subclasses and incident hypertension in adults. Am J Clin Nutr. 2011; 93:338–347. doi: 10.3945/ajcn.110.006783. CrossrefMedlineGoogle Scholar
5.Ding M, Pan A, Manson JE, Willett WC, Malik V, Rosner B, Giovannucci E, Hu FB, Sun Q. Consumption of soy foods and isoflavones and risk of type 2 diabetes: a pooled analysis of three US cohorts. Eur J Clin Nutr. 2016; 70:1381–1387. doi: 10.1038/ejcn.2016.117. CrossrefMedlineGoogle Scholar
6.Gu L, Kelm MA, Hammerstone JF, Beecher G, Holden J, Haytowitz D, Gebhardt S, Prior RL. Concentrations of proanthocyanidins in common foods and estimations of normal consumption. J Nutr. 2004; 134:613–617. CrossrefMedlineGoogle Scholar
7.Bondonno CP, Croft KD, Ward N, Considine MJ, Hodgson JM. Dietary flavonoids and nitrate: effects on nitric oxide and vascular function. Nutr Rev. 2015; 73:216–235. doi: 10.1093/nutrit/nuu014. CrossrefMedlineGoogle Scholar
8.Cassidy A, Minihane AM. The role of metabolism (and the microbiome) in defining the clinical efficacy of dietary flavonoids. Am J Clin Nutr. 2017; 105:10–22. doi: 10.3945/ajcn.116.136051. CrossrefMedlineGoogle Scholar
9.Goya L, Martín MÁ, Sarriá B, Ramos S, Mateos R, Bravo L. Effect of cocoa and its flavonoids on biomarkers of inflammation: studies of cell culture, animals and humans. Nutrients. 2016; 8:212. doi: 10.3390/nu8040212. CrossrefMedlineGoogle Scholar
10.Legeay S, Rodier M, Fillon L, Faure S, Clere N. Epigallocatechin gallate: a review of its beneficial properties to prevent metabolic syndrome. Nutrients. 2015; 7:5443–5468. doi: 10.3390/nu7075230.CrossrefMedlineGoogle Scholar
11.Mangels DR, Mohler ERCatechins as potential mediators of cardiovascular health. Arterioscler Thromb Vasc Biol. 2017; 37:757–763. doi: 10.1161/ATVBAHA.117.309048. LinkGoogle Scholar
12.Ramdath DD, Padhi EM, Sarfaraz S, Renwick S, Duncan AM. Beyond the cholesterol-lowering effect of soy protein: a review of the effects of dietary soy and its constituents on risk factors for cardiovascular disease. Nutrients. 2017; 9:E324. doi: 10.3390/nu9040324. CrossrefMedlineGoogle Scholar
13.Talaei M, Pan A. Role of phytoestrogens in prevention and management of type 2 diabetes. World J Diabetes. 2015; 6:271–283. doi: 10.4239/wjd.v6.i2.271. CrossrefMedlineGoogle Scholar
14.Vitale DC, Piazza C, Melilli B, Drago F, Salomone S. Isoflavones: estrogenic activity, biological effect and bioavailability.Eur J Drug Metab Pharmacokinet. 2013; 38:15–25. doi: 10.1007/s13318-012-0112-y. CrossrefMedlineGoogle Scholar
15.Williamson G, Clifford MN. Colonic metabolites of berry polyphenols: the missing link to biological activity? Br J Nutr. 2010; 104(suppl 3):S48–S66. doi: 10.1017/S0007114510003946. CrossrefMedlineGoogle Scholar
16.van Duynhoven J, Vaughan EE, Jacobs DM, Kemperman RA, van Velzen EJ, Gross G, Roger LC, Possemiers S, Smilde AK, Dore J, Westerhuis JA, Van de Wiele T. Metabolic fate of polyphenols in the human superorganism. Proc Nat Acad Sci USA. 2011; 108(suppl 1):4531–4538. CrossrefMedlineGoogle Scholar
17.Czank C, Cassidy A, Zhang Q, Morrison DJ, Preston T, Kroon PA, Botting NP, Kay CD. Human metabolism and elimination of the anthocyanin, cyanidin-3-glucoside: a (13)C-tracer study. Am J Clin Nutr. 2013; 97:995–1003. doi: 10.3945/ajcn.112.049247. CrossrefMedlineGoogle Scholar
18.de Ferrars RM, Czank C, Zhang Q, Botting NP, Kroon PA, Cassidy A, Kay CD. The pharmacokinetics of anthocyanins and their metabolites in humans. Br J Pharmacol. 2014; 171:3268–3282. doi: 10.1111/bph.12676. CrossrefMedlineGoogle Scholar
19.van Duynhoven J, van der Hooft JJ, van Dorsten FA, Peters S, Foltz M, Gomez-Roldan V, Vervoort J, de Vos RC, Jacobs DM. Rapid and sustained systemic circulation of conjugated gut microbial catabolites after single-dose black tea extract consumption. J Proteome Res. 2014; 13:2668–2678. doi: 10.1021/pr5001253. CrossrefMedlineGoogle Scholar
20.Amin HP, Czank C, Raheem S, Zhang Q, Botting NP, Cassidy A, Kay CD. Anthocyanins and their physiologically relevant metabolites alter the expression of IL-6 and VCAM-1 in CD40L and oxidized LDL challenged vascular endothelial cells. Mol Nutr Food Res. 2015; 59:1095–1106. doi: 10.1002/mnfr.201400803. CrossrefMedlineGoogle Scholar
21.di Gesso JL, Kerr JS, Zhang Q, Raheem S, Yalamanchili SK, O’Hagan D, Kay CD, O’Connell MA. Flavonoid metabolites reduce tumor necrosis factor-α secretion to a greater extent than their precursor compounds in human THP-1 monocytes. Mol Nutr Food Res. 2015; 59:1143–1154. doi: 10.1002/mnfr.201400799. CrossrefMedlineGoogle Scholar
22.Warner EF, Zhang Q, Raheem KS, O’Hagan D, O’Connell MA, Kay CD. Common phenolic metabolites of flavonoids, but not their unmetabolized precursors, reduce the secretion of vascular cellular adhesion molecules by human endothelial cells .J Nutr. 2016; 146:465–473. doi: 10.3945/jn.115.217943. CrossrefMedlineGoogle Scholar
23.Fernández-Millán E, Ramos S, Alvarez C, Bravo L, Goya L, Martín MÁ. Microbial phenolic metabolites improve glucose-stimulated insulin secretion and protect pancreatic beta cells against tert-butyl hydroperoxide-induced toxicity via ERKs and PKC pathways. Food Chem Toxicol. 2014; 66:245–253. doi: 10.1016/j.fct.2014.01.044. CrossrefMedlineGoogle Scholar
24.Kemperman RA, Gross G, Mondot S, Possemiers S, Marzorati M, de Wiele TV, Dore J, Vaughan EE. Impact of polyphenols from black tea and red wine/grape juice on a gut model microbiome. Food Res Intern. 2013; 53:659–669. CrossrefGoogle Scholar
25.Ruan JQ, Li S, Li YP, Wu WJ, Lee SM, Yan R. The presystemic interplay between gut microbiota and orally administered calycosin-7-O-β-D-glucoside. Drug Metab Dispos. 2015; 43:1601–1611. doi: 10.1124/dmd.115.065094. CrossrefMedlineGoogle Scholar
26.Anhê FF, Roy D, Pilon G, Dudonné S, Matamoros S, Varin TV, Garofalo C, Moine Q, Desjardins Y, Levy E, Marette A. A polyphenol-rich cranberry extract protects from diet-induced obesity, insulin resistance and intestinal inflammation in association with increased Akkermansia spp. population in the gut microbiota of mice. Gut. 2015; 64:872–883. doi: 10.1136/gutjnl-2014-307142. CrossrefMedlineGoogle Scholar
27.Roopchand DE, Carmody RN, Kuhn P, Moskal K, Rojas-Silva P, Turnbaugh PJ, Raskin I. Dietary polyphenols promote growth of the gut bacterium Akkermansia muciniphila and attenuate high-fat diet-induced metabolic syndrome. Diabetes. 2015; 64:2847–2858. doi: 10.2337/db14-1916. CrossrefMedlineGoogle Scholar
28.Collins B, Hoffman J, Martinez K, Grace M, Lila MA, Cockrell C, Nadimpalli A, Chang E, Chuang CC, Zhong W, Mackert J, Shen W, Cooney P, Hopkins R, McIntosh M. A polyphenol-rich fraction obtained from table grapes decreases adiposity, insulin resistance and markers of inflammation and impacts gut microbiota in high-fat-fed mice J Nutr Biochem. 2016; 31:150–165. doi: 10.1016/j.jnutbio.2015.12.021. CrossrefMedlineGoogle Scholar
29.Everard A, Belzer C, Geurts L, Ouwerkerk JP, Druart C, Bindels LB, Guiot Y, Derrien M, Muccioli GG, Delzenne NM, de Vos WM, Cani PD. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proc Natl Acad Sci USA. 2013; 110:9066–9071. CrossrefMedlineGoogle Scholar
30.Plovier H, Everard A, Druart C, et al.. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice. Nat Med. 2017; 23:107–113. doi: 10.1038/nm.4236. CrossrefMedlineGoogle Scholar
31.Mosele JI, Macià A, Motilva MJ. Metabolic and microbial modulation of the large intestine ecosystem by non-absorbed diet phenolic compounds: a review. Molecules. 2015; 20:17429–17468. doi: 10.3390/molecules200917429. CrossrefMedlineGoogle Scholar
32.den Besten G, van Eunen K, Groen AK, Venema K, Reijngoud DJ, Bakker BM. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism. J Lipid Res. 2013; 54:2325–2340. doi: 10.1194/jlr.R036012. CrossrefMedlineGoogle Scholar
33.Gao Z, Yin J, Zhang J, Ward RE, Martin RJ, Lefevre M, Cefalu WT, Ye J. Butyrate improves insulin sensitivity and increases energy expenditure in mice. Diabetes. 2009; 58:1509–1517. doi: 10.2337/db08-1637. CrossrefMedlineGoogle Scholar
34.De Vadder F, Kovatcheva-Datchary P, Goncalves D, Vinera J, Zitoun C, Duchampt A, Bäckhed F, Mithieux G. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits. Cell. 2014; 156:84–96. doi: 10.1016/j.cell.2013.12.016. CrossrefMedlineGoogle Scholar
35.den Besten G, Bleeker A, Gerding A, van Eunen K, Havinga R, van Dijk TH, Oosterveer MH, Jonker JW, Groen AK, Reijngoud DJ, Bakker BM. Short-chain fatty acids protect against high-fat diet-induced obesity via a PPARγ-dependent switch from lipogenesis to fat oxidation. Diabetes. 2015; 64:2398–2408. doi: 10.2337/db14-1213. CrossrefMedlineGoogle Scholar
36.Kimura I, Ozawa K, Inoue D, Imamura T, Kimura K, Maeda T, Terasawa K, Kashihara D, Hirano K, Tani T, Takahashi T, Miyauchi S, Shioi G, Inoue H, Tsujimoto G. The gut microbiota suppresses insulin-mediated fat accumulation via the short-chain fatty acid receptor GPR43. Nat Commun. 2013; 4:1829. doi: 10.1038/ncomms2852. CrossrefMedlineGoogle Scholar
37.Frost G, Sleeth ML, Sahuri-Arisoylu M, et al.. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nat Commun. 2014; 5:3611. doi: 10.1038/ncomms4611. CrossrefMedlineGoogle Scholar
38.Perry RJ, Peng L, Barry NA, Cline GW, Zhang D, Cardone RL, Petersen KF, Kibbey RG, Goodman AL, Shulman GI. Acetate mediates a microbiome-brain-β-cell axis to promote metabolic syndrome. Nature. 2016; 534:213–217. CrossrefMedlineGoogle Scholar
39.Natarajan N, Pluznick JL. From microbe to man: the role of microbial short chain fatty acid metabolites in host cell biology. Am J Physiol Cell Physiol. 2014; 307:C979–C985. doi: 10.1152/ajpcell.00228.2014. CrossrefMedlineGoogle Scholar
40.Maslowski KM, Vieira AT, Ng A, Kranich J, Sierro F, Yu D, Schilter HC, Rolph MS, Mackay F, Artis D, Xavier RJ, Teixeira MM, Mackay CR. Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43. Nature. 2009; 461:1282–1286. doi: 10.1038/nature08530. CrossrefMedlineGoogle Scholar
41.Andrade-Oliveira V, Amano MT, Correa-Costa M, et al.. Gut bacteria products prevent AKI induced by ischemia-reperfusion. J Am Soc Nephrol. 2015; 26:1877–1888. doi: 10.1681/ASN.2014030288. CrossrefMedlineGoogle Scholar
42.Natarajan N, Hori D, Flavahan S, Steppan J, Flavahan NA, Berkowitz DE, Pluznick JL. Microbial short chain fatty acid metabolites lower blood pressure via endothelial G-protein coupled receptor 41. Physiol Genomics. 2016; 48:826–834. doi: 10.1152/physiolgenomics.00089.2016. CrossrefMedlineGoogle Scholar
43.Vinolo MA, Rodrigues HG, Hatanaka E, Sato FT, Sampaio SC, Curi R. Suppressive effect of short-chain fatty acids on production of proinflammatory mediators by neutrophils. J Nutr Biochem. 2011; 22:849–855. doi: 10.1016/j.jnutbio.2010.07.009. CrossrefMedlineGoogle Scholar
44.Morrison DJ, Preston T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism. Gut Microbes. 2016; 7:189–200. doi: 10.1080/19490976.2015.1134082. CrossrefMedlineGoogle Scholar
45.Hanhineva K, Törrönen R, Bondia-Pons I, Pekkinen J, Kolehmainen M, Mykkänen H, Poutanen K. Impact of dietary polyphenols on carbohydrate metabolism. Int J Mol Sci. 2010; 11:1365–1402. doi: 10.3390/ijms11041365. CrossrefMedlineGoogle Scholar
46.Eid HM, Martineau LC, Saleem A, Muhammad A, Vallerand D, Benhaddou-Andaloussi A, Nistor L, Afshar A, Arnason JT, Haddad PS. Stimulation of AMP-activated protein kinase and enhancement of basal glucose uptake in muscle cells by quercetin and quercetin glycosides, active principles of the antidiabetic medicinal plant Vaccinium vitis-idaea. Mol Nutr Food Res. 2010; 54:991–1003. doi: 10.1002/mnfr.200900218. CrossrefMedlineGoogle Scholar
47.Kim MS, Hur HJ, Kwon DY, Hwang JT. Tangeretin stimulates glucose uptake via regulation of AMPK signaling pathways in C2C12 myotubes and improves glucose tolerance in high-fat diet-induced obese mice. Mol Cell Endocrinol. 2012; 358:127–134. doi: 10.1016/j.mce.2012.03.013. CrossrefMedlineGoogle Scholar
48.Ding L, Jin D, Chen X. Luteolin enhances insulin sensitivity via activation of PPARγ transcriptional activity in adipocytes. J Nutr Biochem. 2010; 21:941–947. doi: 10.1016/j.jnutbio.2009.07.009. CrossrefMedlineGoogle Scholar
49.Vazquez Prieto MA, Bettaieb A, Rodriguez Lanzi C, Soto VC, Perdicaro DJ, Galmarini CR, Haj FG, Miatello RM, Oteiza PI. Catechin and quercetin attenuate adipose inflammation in fructose-fed rats and 3T3-L1 adipocytes. Mol Nutr Food Res. 2015; 59:622–633. doi: 10.1002/mnfr.201400631. CrossrefMedlineGoogle Scholar
50.Goto T, Teraminami A, Lee JY, Ohyama K, Funakoshi K, Kim YI, Hirai S, Uemura T, Yu R, Takahashi N, Kawada T. Tiliroside, a glycosidic flavonoid, ameliorates obesity-induced metabolic disorders via activation of adiponectin signaling followed by enhancement of fatty acid oxidation in liver and skeletal muscle in obese-diabetic mice .J Nutr Biochem. 2012; 23:768–776. doi: 10.1016/j.jnutbio.2011.04.001. CrossrefMedlineGoogle Scholar
51.Li Z, Xu J, Zheng P, Xing L, Shen H, Yang L, Zhang L, Ji G. Hawthorn leaf flavonoids alleviate nonalcoholic fatty liver disease by enhancing the adiponectin/AMPK pathway. Int J Clin Exp Med. 2015; 8:17295–17307. MedlineGoogle Scholar
52.Lin CL, Huang HC, Lin JK. Theaflavins attenuate hepatic lipid accumulation through activating AMPK in human HepG2 cells. J Lipid Res. 2007; 48:2334–2343. doi: 10.1194/jlr.M700128-JLR200. CrossrefMedlineGoogle Scholar
53.Rodriguez-Ramiro I, Vauzour D, Minihane AM. Polyphenols and non-alcoholic fatty liver disease: impact and mechanisms. Proc Nutr Soc. 2016; 75:47–60. CrossrefMedlineGoogle Scholar
54.Assini JM, Mulvihill EE, Sutherland BG, Telford DE, Sawyez CG, Felder SL, Chhoker S, Edwards JY, Gros R, Huff MW. Naringenin prevents cholesterol-induced systemic inflammation, metabolic dysregulation, and atherosclerosis in Ldlr-/- mice. J Lipid Res. 2013; 54:711–724. doi: 10.1194/jlr.M032631. CrossrefMedlineGoogle Scholar
55.Cai EP, Lin JK. Epigallocatechin gallate (EGCG) and rutin suppress the glucotoxicity through activating IRS2 and AMPK signaling in rat pancreatic beta cells. J Agric Food Chem. 2009; 57:9817–9827. doi: 10.1021/jf902618v. CrossrefMedlineGoogle Scholar
56.Dai X, Ding Y, Zhang Z, Cai X, Li Y. Quercetin and quercitrin protect against cytokine-induced injuries in RINm5F β-cells via the mitochondrial pathway and NF-κB signaling. Int J Mol Med. 2013; 31:265–271. doi: 10.3892/ijmm.2012.1177. CrossrefMedlineGoogle Scholar
57.Fu Z, Zhang W, Zhen W, Lum H, Nadler J, Bassaganya-Riera J, Jia Z, Wang Y, Misra H, Liu D. Genistein induces pancreatic beta-cell proliferation through activation of multiple signaling pathways and prevents insulin-deficient diabetes in mice. Endocrinology. 2010; 151:3026–3037. doi: 10.1210/en.2009-1294. CrossrefMedlineGoogle Scholar
58.Bardy G, Virsolvy A, Quignard JF, Ravier MA, Bertrand G, Dalle S, Cros G, Magous R, Richard S, Oiry C. Quercetin induces insulin secretion by direct activation of L-type calcium channels in pancreatic beta cells. Br J Pharmacol. 2013; 169:1102–1113. doi: 10.1111/bph.12194. CrossrefMedlineGoogle Scholar
59.Kappel VD, Frederico MJ, Postal BG, Mendes CP, Cazarolli LH, Silva FR. The role of calcium in intracellular pathways of rutin in rat pancreatic islets: potential insulin secretagogue effect. Eur J Pharmacol. 2013; 702:264–268. doi: 10.1016/j.ejphar.2013.01.055. CrossrefMedlineGoogle Scholar
60.Clark JL, Zahradka P, Taylor CG. Efficacy of flavonoids in the management of high blood pressure. Nutr Rev. 2015; 73:799–822. doi: 10.1093/nutrit/nuv048. CrossrefMedlineGoogle Scholar
61.Li PG, Sun L, Han X, Ling S, Gan WT, Xu JW. Quercetin induces rapid eNOS phosphorylation and vasodilation by an Akt-independent and PKA-dependent mechanism. Pharmacology. 2012; 89:220–228. doi: 10.1159/000337182. CrossrefMedlineGoogle Scholar
62.Olaleye MT, Crown OO, Akinmoladun AC, Akindahunsi AA. Rutin and quercetin show greater efficacy than nifedipin in ameliorating hemodynamic, redox, and metabolite imbalances in sodium chloride-induced hypertensive rats. Hum Exp Toxicol. 2014; 33:602–608. doi: 10.1177/0960327113504790. CrossrefMedlineGoogle Scholar
63.Rivera L, Morón R, Sánchez M, Zarzuelo A, Galisteo M. Quercetin ameliorates metabolic syndrome and improves the inflammatory status in obese Zucker rats. Obesity (Silver Spring). 2008; 16:2081–2087. doi: 10.1038/oby.2008.315. CrossrefMedlineGoogle Scholar
64.Croft KD. Dietary polyphenols: antioxidants or not? Arch Biochem Biophys. 2016; 595:120–124. doi: 10.1016/j.abb.2015.11.014. CrossrefMedlineGoogle Scholar
65.Kukongviriyapan U, Sompamit K, Pannangpetch P, Kukongviriyapan V, Donpunha W. Preventive and therapeutic effects of quercetin on lipopolysaccharide-induced oxidative stress and vascular dysfunction in mice. Can J Physiol Pharmacol. 2012; 90:1345–1353. doi: 10.1139/y2012-101. CrossrefMedlineGoogle Scholar
66.Liu PL, Liu JT, Kuo HF, Chong IW, Hsieh CC. Epigallocatechin gallate attenuates proliferation and oxidative stress in human vascular smooth muscle cells induced by interleukin-1β via heme oxygenase-1. Mediators Inflamm. 2014; 2014:523684. doi: 10.1155/2014/523684. CrossrefMedlineGoogle Scholar
67.Xu C, Chen J, Zhang J, Hu X, Zhou X, Lu Z, Jiang H. Naringenin inhibits angiotensin II-induced vascular smooth muscle cells proliferation and migration and decreases neointimal hyperplasia in balloon injured rat carotid arteries through suppressing oxidative stress. Biol Pharm Bull. 2013; 36:1549–1555. CrossrefMedlineGoogle Scholar
68.Fusi F, Spiga O, Trezza A, Sgaragli G, Saponara S. The surge of flavonoids as novel, fine regulators of cardiovascular Cav channels. Eur J Pharmacol. 2017; 796:158–174. doi: 10.1016/j.ejphar.2016.12.033. CrossrefMedlineGoogle Scholar
69.Mulvihill EE, Allister EM, Sutherland BG, Telford DE, Sawyez CG, Edwards JY, Markle JM, Hegele RA, Huff MW. Naringenin prevents dyslipidemia, apolipoprotein B overproduction, and hyperinsulinemia in LDL receptor-null mice with diet-induced insulin resistance. Diabetes. 2009; 58:2198–2210. doi: 10.2337/db09-0634. CrossrefMedlineGoogle Scholar
70.Hoek-van den Hil EF, van Schothorst EM, van der Stelt I, Swarts HJ, Venema D, Sailer M, Vervoort JJ, Hollman PC, Rietjens IM, Keijer J. Quercetin decreases high-fat diet induced body weight gain and accumulation of hepatic and circulating lipids in mice. Genes Nutr. 2014; 9:418. doi: 10.1007/s12263-014-0418-2. CrossrefMedlineGoogle Scholar
71.Tsutsumi R, Yoshida T, Nii Y, Okahisa N, Iwata S, Tsukayama M, Hashimoto R, Taniguchi Y, Sakaue H, Hosaka T, Shuto E, Sakai T. Sudachitin, a polymethoxylated flavone, improves glucose and lipid metabolism by increasing mitochondrial biogenesis in skeletal muscle. Nutr Metab (Lond). 2014; 11:32. doi: 10.1186/1743-7075-11-32. CrossrefMedlineGoogle Scholar
72.Zhang X, Zhang QX, Wang X, Zhang L, Qu W, Bao B, Liu CA, Liu J. Dietary luteolin activates browning and thermogenesis in mice through an AMPK/PGC1α pathway-mediated mechanism. Int J Obes (Lond). 2016; 40:1841–1849. doi: 10.1038/ijo.2016.108. CrossrefMedlineGoogle Scholar
73.Choi JH, Yun JW. Chrysin induces brown fat-like phenotype and enhances lipid metabolism in 3T3-L1 adipocytes. Nutrition. 2016; 32:1002–1010. doi: 10.1016/j.nut.2016.02.007. CrossrefMedlineGoogle Scholar
74.Kamio N, Suzuki T, Watanabe Y, Suhara Y, Osakabe N. A single oral dose of flavan-3-ols enhances energy expenditure by sympathetic nerve stimulation in mice. Free Radic Biol Med. 2016; 91:256–263. doi: 10.1016/j.freeradbiomed.2015.12.030. CrossrefMedlineGoogle Scholar
75.Watanabe N, Inagawa K, Shibata M, Osakabe N. Flavan-3-ol fraction from cocoa powder promotes mitochondrial biogenesis in skeletal muscle in mice. Lipids Health Dis. 2014; 13:64. doi: 10.1186/1476-511X-13-64. CrossrefMedlineGoogle Scholar
76.Okla M, Kang I, Kim DM, Gourineni V, Shay N, Gu L, Chung S. Ellagic acid modulates lipid accumulation in primary human adipocytes and human hepatoma Huh7 cells via discrete mechanisms. J Nutr Biochem. 2015; 26:82–90. doi: 10.1016/j.jnutbio.2014.09.010. CrossrefMedlineGoogle Scholar
77.Murase T, Misawa K, Minegishi Y, Aoki M, Ominami H, Suzuki Y, Shibuya Y, Hase T. Coffee polyphenols suppress diet-induced body fat accumulation by downregulating SREBP-1c and related molecules in C57BL/6J mice. Am J Physiol Endocrinol Metab. 2011; 300:E122–E133. doi: 10.1152/ajpendo.00441.2010. CrossrefMedlineGoogle Scholar
78.Tung YC, Li S, Huang Q, Hung WL, Ho CT, Wei GJ, Pan MH. 5-Demethylnobiletin and 5-acetoxy-6,7,8,3’,4’-pentamethoxyflavone suppress lipid accumulation by activating the LKB1-AMPK pathway in 3T3-L1 preadipocytes and high fat diet-fed C57BL/6 mice. J Agric Food Chem. 2016; 64:3196–3205. doi: 10.1021/acs.jafc.6b00706. CrossrefMedlineGoogle Scholar
79.Dong J, Zhang X, Zhang L, Bian HX, Xu N, Bao B, Liu J. Quercetin reduces obesity-associated ATM infiltration and inflammation in mice: a mechanism including AMPKα1/SIRT1. J Lipid Res. 2014; 55:363–374. doi: 10.1194/jlr.M038786. CrossrefMedlineGoogle Scholar
80.Lv D, Cheng X, Tang L, Jiang M. The cardioprotective effect of total flavonoids on myocardial ischemia/reperfusion in rats. Biomed Pharmacother. 2017; 88:277–284. doi: 10.1016/j.biopha.2017.01.060. CrossrefMedlineGoogle Scholar
81.Mantawy EM, El-Bakly WM, Esmat A, Badr AM, El-Demerdash E. Chrysin alleviates acute doxorubicin cardiotoxicity in rats via suppression of oxidative stress, inflammation and apoptosis. Eur J Pharmacol. 2014; 728:107–118. doi: 10.1016/j.ejphar.2014.01.065. CrossrefMedlineGoogle Scholar
82.Prince PD, Fischerman L, Toblli JE, Fraga CG, Galleano M. LPS-induced renal inflammation is prevented by (-)-epicatechin in rats. Redox Biol. 2017; 11:342–349. doi: 10.1016/j.redox.2016.12.023. CrossrefMedlineGoogle Scholar
83.Rani N, Bharti S, Bhatia J, Nag TC, Ray R, Arya DS. Chrysin, a PPAR-γ agonist improves myocardial injury in diabetic rats through inhibiting AGE-RAGE mediated oxidative stress and inflammation. Chem Biol Interact. 2016; 250:59–67. doi: 10.1016/j.cbi.2016.03.015. CrossrefMedlineGoogle Scholar
84.Yuan X, Niu HT, Wang PL, Lu J, Zhao H, Liu SH, Zheng QS, Li CG. Cardioprotective effect of licochalcone D against myocardial ischemia/reperfusion injury in langendorff-perfused rat hearts. PLoS One. 2015; 10:e0128375. doi: 10.1371/journal.pone.0128375. MedlineGoogle Scholar
85.Zempo H, Suzuki J, Watanabe R, Wakayama K, Kumagai H, Ikeda Y, Akazawa H, Komuro I, Isobe M. Cacao polyphenols ameliorate autoimmune myocarditis in mice. Hypertens Res. 2016; 39:203–209. doi: 10.1038/hr.2015.136. CrossrefMedlineGoogle Scholar
86.Erlejman AG, Jaggers G, Fraga CG, Oteiza PI. TNFalpha-induced NF-kappaB activation and cell oxidant production are modulated by hexameric procyanidins in Caco-2 cells. Arch Biochem Biophys. 2008; 476:186–195. doi: 10.1016/j.abb.2008.01.024. CrossrefMedlineGoogle Scholar
87.Corti R, Flammer AJ, Hollenberg NK, Lüscher TF. Cocoa and cardiovascular health. Circulation. 2009; 119:1433–1441. doi: 10.1161/CIRCULATIONAHA.108.827022. LinkGoogle Scholar
88.Hooper L, Kay C, Abdelhamid A, Kroon PA, Cohn JS, Rimm EB, Cassidy A. Effects of chocolate, cocoa, and flavan-3-ols on cardiovascular health: a systematic review and meta-analysis of randomized trials. Am J Clin Nutr. 2012; 95:740–751. doi: 10.3945/ajcn.111.023457. CrossrefMedlineGoogle Scholar
89.Shrime MG, Bauer SR, McDonald AC, Chowdhury NH, Coltart CE, Ding EL. Flavonoid-rich cocoa consumption affects multiple cardiovascular risk factors in a meta-analysis of short-term studies. J Nutr. 2011; 141:1982–1988. doi: 10.3945/jn.111.145482. CrossrefMedlineGoogle Scholar
90.Taubert D, Roesen R, Lehmann C, Jung N, Schömig E. Effects of low habitual cocoa intake on blood pressure and bioactive nitric oxide: a randomized controlled trial. JAMA. 2007; 298:49–60. doi: 10.1001/jama.298.1.49. CrossrefMedlineGoogle Scholar
91.Yarmolinsky J, Gon G, Edwards P. Effect of tea on blood pressure for secondary prevention of cardiovascular disease: a systematic review and meta-analysis of randomized controlled trials. Nutr Rev. 2015; 73:236–246. doi: 10.1093/nutrit/nuv001. CrossrefMedlineGoogle Scholar
92.Huang H, Chen G, Liao D, Zhu Y, Xue X. Effects of berries consumption on cardiovascular risk factors: a meta-analysis with trial sequential analysis of randomized controlled trials. Sci Rep. 2016; 6:23625. doi: 10.1038/srep23625. CrossrefMedlineGoogle Scholar
93.Jacques PF, Cassidy A, Rogers G, Peterson JJ, Meigs JB, Dwyer JT. Higher dietary flavonol intake is associated with lower incidence of type 2 diabetes. J Nutr. 2013; 143:1474–1480. doi: 10.3945/jn.113.177212. CrossrefMedlineGoogle Scholar
94.Cassidy A, Mukamal KJ, Liu L, Franz M, Eliassen AH, Rimm EB. High anthocyanin intake is associated with a reduced risk of myocardial infarction in young and middle-aged women. Circulation. 2013; 127:188–196. doi: 10.1161/CIRCULATIONAHA.112.122408. LinkGoogle Scholar
95.Cassidy A, Bertoia M, Chiuve S, Flint A, Forman J, Rimm EB. Habitual intake of anthocyanins and flavanones and risk of cardiovascular disease in men. Am J Clin Nutr. 2016; 104:587–594. doi: 10.3945/ajcn.116.133132.C rossrefMedlineGoogle Scholar
96.Goetz ME, Judd SE, Hartman TJ, McClellan W, Anderson A, Vaccarino V. Flavanone intake is inversely associated with risk of incident ischemic stroke in the REasons for Geographic and Racial Differences in Stroke (REGARDS) study. J Nutr. 2016; 146:2233–2243. doi: 10.3945/jn.116.230185. CrossrefMedlineGoogle Scholar
97.Goetz ME, Judd SE, Safford MM, Hartman TJ, McClellan WM, Vaccarino V. Dietary flavonoid intake and incident coronary heart disease: the REasons for Geographic and Racial Differences in Stroke (REGARDS) study. m J Clin Nutr. 2016; 104:1236–1244. doi: 10.3945/ajcn.115.129452. CrossrefMedlineGoogle Scholar
98.Buitrago-Lopez A, Sanderson J, Johnson L, Warnakula S, Wood A, Di Angelantonio E, Franco OH. Chocolate consumption and cardiometabolic disorders: systematic review and meta-analysis. BMJ. 2011; 343:d4488. CrossrefMedlineGoogle Scholar
99.Guo X, Yang B, Tan J, Jiang J, Li D. Associations of dietary intakes of anthocyanins and berry fruits with risk of type 2 diabetes mellitus: a systematic review and meta-analysis of prospective cohort studies. Eur J Clin Nutr. 2016; 70:1360–1367. doi: 10.1038/ejcn.2016.142. CrossrefMedlineGoogle Scholar
100.Zamora-Ros R, Touillaud M, Rothwell JA, Romieu I, Scalbert A. Measuring exposure to the polyphenol metabolome in observational epidemiologic studies: current tools and applications and their limits. Am J Clin Nutr. 2014; 100:11–26. doi: 10.3945/ajcn.113.077743. CrossrefMedlineGoogle Scholar
101.Rienks J, Barbaresko J, Nöthlings U. Association of isoflavone biomarkers with risk of chronic disease and mortality: a systematic review and meta-analysis of observational studies. Nutr Rev. 2017; 75:616–641. doi: 10.1093/nutrit/nux021. CrossrefMedlineGoogle Scholar
102.Bredsdorff L, Obel T, Dethlefsen C, Tjønneland A, Schmidt EB, Rasmussen SE, Overvad K. Urinary flavonoid excretion and risk of acute coronary syndrome in a nested case-control study. Am J Clin Nutr. 2013; 98:209–216. doi: 10.3945/ajcn.112.046169. CrossrefMedlineGoogle Scholar
103.Sun Q, Wedick NM, Tworoger SS, Pan A, Townsend MK, Cassidy A, Franke AA, Rimm EB, Hu FB, van Dam RM. Urinary excretion of select dietary polyphenol metabolites is associated with a lower risk of type 2 diabetes in proximate but not remote follow-up in a prospective investigation in 2 cohorts of US women. J Nutr. 2015; 145:1280–1288. doi: 10.3945/jn.114.208736. CrossrefMedlineGoogle Scholar
104.Yu D, Shu XO, Li H, Yang G, Cai Q, Xiang YB, Ji BT, Franke AA, Gao YT, Zheng W, Zhang X. Dietary isoflavones, urinary isoflavonoids, and risk of ischemic stroke in women. Am J Clin Nutr. 2015; 102:680–686. doi: 10.3945/ajcn.115.111591. CrossrefMedlineGoogle Scholar
105.Zhang X, Gao YT, Yang G, Li H, Cai Q, Xiang YB, Ji BT, Franke AA, Zheng W, Shu XO. Urinary isoflavonoids and risk of coronary heart disease. Int J Epidemiol. 2012; 41:1367–1375. doi: 10.1093/ije/dys130. CrossrefMedlineGoogle Scholar
106.Casas R, Sacanella E, Urpí-Sardà M, Chiva-Blanch G, Ros E, Martínez-González MA, Covas MI, Salas-Salvadó J, Fiol M, Arós F, Estruch R; Rosa Ma Lamuela-Raventos. The effects of the mediterranean diet on biomarkers of vascular wall inflammation and plaque vulnerability in subjects with high risk for cardiovascular disease. A randomized trial. PLoS One. 2014; 9:e100084. doi: 10.1371/journal.pone.0100084. CrossrefMedlineGoogle Scholar
107.Casas R, Sacanella E, Urpí-Sardà M, Corella D, Castañer O, Lamuela-Raventos RM, Salas-Salvadó J, Martínez-González MA, Ros E, Estruch R. Long-term immunomodulatory effects of a Mediterranean diet in adults at high risk of cardiovascular disease in the PREvención con DIeta MEDiterránea (PREDIMED) randomized controlled trial. J Nutr. 2016; 146:1684–1693. doi: 10.3945/jn.115.229476. CrossrefMedlineGoogle Scholar
108.Hernaez A, Castaner O, Goday A, et al.. The Mediterranean diet decreases LDL atherogenicity in high cardiovascular risk individuals: a randomized controlled trial. Mol Nutr Food Res. 2017; 61. CrossrefGoogle Scholar
109.Estruch R, Ros E, Salas-Salvadó J, et al.; PREDIMED Study Investigators. Primary prevention of cardiovascular disease with a Mediterranean diet. N Engl J Med. 2013; 368:1279–1290. doi: 10.1056/NEJMoa1200303. CrossrefMedlineGoogle Scholar
110.Estruch R, Martínez-González MA, Corella D, et al.; PREDIMED Study Investigators. Effect of a high-fat Mediterranean diet on bodyweight and waist circumference: a prespecified secondary outcomes analysis of the PREDIMED randomised controlled trial. Lancet Diabetes Endocrinol. 2016; 4:666–676. doi: 10.1016/S2213-8587(16)30085-7. CrossrefMedlineGoogle Scholar
111.Aune D, Keum N, Giovannucci E, Fadnes LT, Boffetta P, Greenwood DC, Tonstad S, Vatten LJ, Riboli E, Norat T. Nut consumption and risk of cardiovascular disease, total cancer, all-cause and cause-specific mortality: a systematic review and dose-response meta-analysis of prospective studies. BMC Med. 2016; 14:207. doi: 10.1186/s12916-016-0730-3. CrossrefMedlineGoogle Scholar
112.National Research Council (US) Committee on Technological Options to Improve the Nutritional Attributes of Animal Products. Current trends in consumption of animal products. In: Designing Foods: Animal Product Options in the Marketplace. Washington, DC: National Academies Press (US); 1988:18–44. Google Scholar
113.Dietary Guidelines Advisory Committee. Scientific Report of the 2015 Dietary Guidelines Advisory Committee.2015; 2015. https://health.gov/dietaryguidelines/2015-scientific-report/.Google Scholar
114.Leung PS. The potential protective action of vitamin D in hepatic insulin resistance and pancreatic islet dysfunction in type 2 diabetes mellitus. Nutrients. 2016; 8:147. doi: 10.3390/nu8030147. CrossrefMedlineGoogle Scholar
115.Muscogiuri G, Annweiler C, Duval G, Karras S, Tirabassi G, Salvio G, Balercia G, Kimball S, Kotsa K, Mascitelli L, Bhattoa HP, Colao A. Vitamin D and cardiovascular disease: from atherosclerosis to myocardial infarction and stroke. Int J Cardiol. 2017; 230:577–584. doi: 10.1016/j.ijcard.2016.12.053. CrossrefMedlineGoogle Scholar
116.Conceição EP, Moura EG, Soares PN, Ai XX, Figueiredo MS, Oliveira E, Lisboa PC. High calcium diet improves the liver oxidative stress and microsteatosis in adult obese rats that were overfed during lactation. Food Chem Toxicol. 2016; 92:245–255. doi: 10.1016/j.fct.2016.04.015. CrossrefMedlineGoogle Scholar
117.Sun X, Zemel MB. Dietary calcium regulates ROS production in aP2-agouti transgenic mice on high-fat/high-sucrose diets. Int J Obes (Lond). 2006; 30:1341–1346. doi: 10.1038/sj.ijo.0803294. CrossrefMedlineGoogle Scholar
118.Nobre JL, Lisboa PC, Lima Nda S, Franco JG, Nogueira Neto JF, de Moura EG, de Oliveira E. Calcium supplementation prevents obesity, hyperleptinaemia and hyperglycaemia in adult rats programmed by early weaning. Br J Nutr. 2012; 107:979–988. doi: 10.1017/S0007114511003928. CrossrefMedlineGoogle Scholar
119.Conceição EPS, Moura EG, Oliveira E, Guarda DS, Figueiredo MS, Quitete FT, Calvino C, Miranda RA, Mathias PCF, Manhães AC, Lisboa PC. Dietary calcium supplementation in adult rats reverts brown adipose tissue dysfunction programmed by postnatal early overfeeding. J Nutr Biochem. 2017; 39:117–125. doi: 10.1016/j.jnutbio.2016.09.013. CrossrefMedlineGoogle Scholar
120.Quitete FT, Nobre JL, Peixoto-Silva N, de Moura EG, Lisboa PC, de Oliveira E. Anti-obesogenic effects of calcium prevent changes in the GLP-1 profile in adult rats primed by early weaning. Mol Nutr Food Res. 2015; 59:773–783. doi: 10.1002/mnfr.201400666. CrossrefMedlineGoogle Scholar
121.Sun X, Zemel MB. Calcium and 1,25-dihydroxyvitamin D3 regulation of adipokine expression. Obesity (Silver Spring). 2007; 15:340–348. doi: 10.1038/oby.2007.540. CrossrefMedlineGoogle Scholar
122.Sun X, Zemel MB. Calcitriol and calcium regulate cytokine production and adipocyte-macrophage cross-talk. J Nutr Biochem. 2008; 19:392–399. doi: 10.1016/j.jnutbio.2007.05.013. CrossrefMedlineGoogle Scholar
123.Chaplin A, Parra P, Laraichi S, Serra F, Palou A. Calcium supplementation modulates gut microbiota in a prebiotic manner in dietary obese mice. Mol Nutr Food Res. 2016; 60:468–480. doi: 10.1002/mnfr.201500480. CrossrefMedlineGoogle Scholar
124.Gomes JM, Costa JA, Alfenas RC. Could the beneficial effects of dietary calcium on obesity and diabetes control be mediated by changes in intestinal microbiota and integrity? Br J Nutr. 2015; 114:1756–1765. doi: 10.1017/S0007114515003608. CrossrefMedlineGoogle Scholar
125.de Wit NJ, Bosch-Vermeulen H, Oosterink E, Müller M, van der Meer R. Supplementary dietary calcium stimulates faecal fat and bile acid excretion, but does not protect against obesity and insulin resistance in C57BL/6J mice. Br J Nutr. 2011; 105:1005–1011. doi: 10.1017/S0007114510004654. CrossrefMedlineGoogle Scholar
126.Thomas AP, Dunn TN, Drayton JB, Oort PJ, Adams SH. A high calcium diet containing nonfat dry milk reduces weight gain and associated adipose tissue inflammation in diet-induced obese mice when compared to high calcium alone. Nutr Metab (Lond). 2012; 9:3. doi: 10.1186/1743-7075-9-3. CrossrefMedlineGoogle Scholar
127.Thomas AP, Dunn TN, Drayton JB, Oort PJ, Adams SH. A dairy-based high calcium diet improves glucose homeostasis and reduces steatosis in the context of preexisting obesity. Obesity (Silver Spring). 2013; 21:E229–E235. doi: 10.1002/oby.20039. CrossrefMedlineGoogle Scholar
128.Booth AO, Huggins CE, Wattanapenpaiboon N, Nowson CA. Effect of increasing dietary calcium through supplements and dairy food on body weight and body composition: a meta-analysis of randomised controlled trials. Br J Nutr. 2015; 114:1013–1025. doi: 10.1017/S0007114515001518. CrossrefMedlineGoogle Scholar
129.Cormick G, Ciapponi A, Cafferata ML, Belizan JM. Calcium supplementation for prevention of primary hypertension. Cochrane Database Syst Rev. 2015:CD010037. MedlineGoogle Scholar
130.Jolma P, Kalliovalkama J, Tolvanen JP, Kööbi P, Kähönen M, Hutri-Kähönen N, Wu X, Pörsti I. High-calcium diet enhances vasorelaxation in nitric oxide-deficient hypertension. Am J Physiol Heart Circ Physiol. 2000; 279:H1036–H1043. doi: 10.1152/ajpheart.2000.279.3.H1036. CrossrefMedlineGoogle Scholar
131.Mäkynen H, Kähönen M, Wu X, Arvola P, Pörsti I. Endothelial function in deoxycorticosterone-NaCl hypertension: effect of calcium supplementation. Circulation. 1996; 93:1000–1008. CrossrefMedlineGoogle Scholar
132.McCarron DA, Lucas PA, Shneidman RJ, LaCour B, Drüeke T. Blood pressure development of the spontaneously hypertensive rat after concurrent manipulations of dietary Ca2+ and Na+. Relation to intestinal Ca2+ fluxes. J Clin Invest. 1985; 76:1147–1154. doi: 10.1172/JCI112070. CrossrefMedlineGoogle Scholar
133.Pörsti I, Fan M, Kööbi P, Jolma P, Kalliovalkama J, Vehmas TI, Helin H, Holthöfer H, Mervaala E, Nyman T, Tikkanen I. High calcium diet down-regulates kidney angiotensin-converting enzyme in experimental renal failure. Kidney Int. 2004; 66:2155–2166. doi: 10.1111/j.1523-1755.2004.66006.x. CrossrefMedlineGoogle Scholar
134.Bolland MJ, Grey A, Avenell A, Gamble GD, Reid IR. Calcium supplements with or without vitamin D and risk of cardiovascular events: reanalysis of the Women’s Health Initiative limited access dataset and meta-analysis. BMJ. 2011; 342:d2040. CrossrefMedlineGoogle Scholar
135.Mao PJ, Zhang C, Tang L, Xian YQ, Li YS, Wang WD, Zhu XH, Qiu HL, He J, Zhou YH. Effect of calcium or vitamin D supplementation on vascular outcomes: a meta-analysis of randomized controlled trials. Int J Cardiol. 2013; 169:106–111. doi: 10.1016/j.ijcard.2013.08.055. CrossrefMedlineGoogle Scholar
136.Larsson SC, Burgess S, Michaëlsson K. Association of genetic variants related to serum calcium levels with coronary artery disease and myocardial infarction .JAMA. 2017; 318:371–380. doi: 10.1001/jama.2017.8981. CrossrefMedlineGoogle Scholar
137.Fekete AA, Givens DI, Lovegrove JA. Can milk proteins be a useful tool in the management of cardiometabolic health? An updated review of human intervention trials. Proc Nutr Soc. 2016; 75:328–341. CrossrefMedlineGoogle Scholar
138.Healy NP, Kirwan AM, McArdle MA, et al.. A casein hydrolysate protects mice against high fat diet induced hyperglycemia by attenuating NLRP3 inflammasome-mediated inflammation and improving insulin signaling. Mol Nutr Food Res. 2016; 60:2421–2432. doi: 10.1002/mnfr.201501054. CrossrefMedlineGoogle Scholar
139.Pezeshki A, Fahim A, Chelikani PK. Dietary whey and casein differentially affect energy balance, gut hormones, glucose metabolism, and taste preference in diet-induced obese rats. J Nutr. 2015; 145:2236–2244. doi: 10.3945/jn.115.213843. CrossrefMedlineGoogle Scholar
140.Singh A, Pezeshki A, Zapata RC, Yee NJ, Knight CG, Tuor UI, Chelikani PK. Diets enriched in whey or casein improve energy balance and prevent morbidity and renal damage in salt-loaded and high-fat-fed spontaneously hypertensive stroke-prone rats. J Nutr Biochem. 2016; 37:47–59. doi: 10.1016/j.jnutbio.2016.07.011. CrossrefMedlineGoogle Scholar
141.Li H, Xu M, Lee J, He C, Xie Z. Leucine supplementation increases SIRT1 expression and prevents mitochondrial dysfunction and metabolic disorders in high-fat diet-induced obese mice. Am J Physiol Endocrinol Metab. 2012; 303:E1234–E1244. doi: 10.1152/ajpendo.00198.2012. CrossrefMedlineGoogle Scholar
142.Ren M, Zhang S, Liu X, Li S, Mao X, Zeng X, Qiao S. Different lipopolysaccharide branched-chain amino acids modulate porcine intestinal endogenous β-defensin expression through the Sirt1/ERK/90RSK pathway. J Agric Food Chem. 2016; 64:3371–3379. doi: 10.1021/acs.jafc.6b00968. CrossrefMedlineGoogle Scholar
143.Jakubowicz D, Froy O. Biochemical and metabolic mechanisms by which dietary whey protein may combat obesity and type 2 diabetes. J Nutr Biochem. 2013; 24:1–5. doi: 10.1016/j.jnutbio.2012.07.008. CrossrefMedlineGoogle Scholar
144.Tong X, Li W, Xu JY, Han S, Qin LQ. Effects of whey protein and leucine supplementation on insulin resistance in non-obese insulin-resistant model rats. Nutrition. 2014; 30:1076–1080. doi: 10.1016/j.nut.2014.01.013. CrossrefMedlineGoogle Scholar
145.Newgard CB, An J, Bain JR, et al.. A branched-chain amino acid-related metabolic signature that differentiates obese and lean humans and contributes to insulin resistance. Cell Metab. 2009; 9:311–326. doi: 10.1016/j.cmet.2009.02.002. CrossrefMedlineGoogle Scholar
146.Zhenyukh O, Civantos E, Ruiz-Ortega M, Sánchez MS, Vázquez C, Peiró C, Egido J, Mas S. High concentration of branched-chain amino acids promotes oxidative stress, inflammation and migration of human peripheral blood mononuclear cells via mTORC1 activation. Free Radic Biol Med. 2017; 104:165–177. doi: 10.1016/j.freeradbiomed.2017.01.009. CrossrefMedlineGoogle Scholar
147.Pedroso JA, Zampieri TT, Donato JReviewing the effects of L-leucine supplementation in the regulation of food intake, energy balance, and glucose homeostasis. Nutrients. 2015; 7:3914–3937. doi: 10.3390/nu7053914. CrossrefMedlineGoogle Scholar
148.Fekete ÁA, Givens DI, Lovegrove JA. The impact of milk proteins and peptides on blood pressure and vascular function: a review of evidence from human intervention studies. Nutr Res Rev. 2013; 26:177–190. doi: 10.1017/S0954422413000139. CrossrefMedlineGoogle Scholar
149.Fekete ÁA, Givens DI, Lovegrove JA. Casein-derived lactotripeptides reduce systolic and diastolic blood pressure in a meta-analysis of randomised clinical trials. Nutrients. 2015; 7:659–681. doi: 10.3390/nu7010659. CrossrefMedlineGoogle Scholar
150.Capriotti AL, Cavaliere C, Piovesana S, Samperi R, Laganà A. Recent trends in the analysis of bioactive peptides in milk and dairy products. Anal Bioanal Chem. 2016; 408:2677–2685. doi: 10.1007/s00216-016-9303-8. CrossrefMedlineGoogle Scholar
151.Jäkälä P, Vapaatalo H. Antihypertensive peptides from milk proteins. Pharmaceuticals (Basel). 2010; 3:251–272. doi: 10.3390/ph3010251. CrossrefMedlineGoogle Scholar
152.Zhang Y, Chen R, Ma H, Chen S. Isolation and identification of dipeptidyl peptidase IV-inhibitory peptides from trypsin/chymotrypsin-treated goat milk casein hydrolysates by 2D-TLC and LC-MS/MS. J Agric Food Chem. 2015; 63:8819–8828. doi: 10.1021/acs.jafc.5b03062. CrossrefMedlineGoogle Scholar
153.Tulipano G, Sibilia V, Caroli AM, Cocchi D. Whey proteins as source of dipeptidyl dipeptidase IV (dipeptidyl peptidase-4) inhibitors. Peptides. 2011; 32:835–838. doi: 10.1016/j.peptides.2011.01.002. CrossrefMedlineGoogle Scholar
154.Foltz M, van der Pijl PC, Duchateau GS. Current in vitro testing of bioactive peptides is not valuable. J Nutr. 2010; 140:117–118. doi: 10.3945/jn.109.116228. CrossrefMedlineGoogle Scholar
155.Micha R, Mozaffarian D. Saturated fat and cardiometabolic risk factors, coronary heart disease, stroke, and diabetes: a fresh look at the evidence. Lipids. 2010; 45:893–905. doi: 10.1007/s11745-010-3393-4. CrossrefMedlineGoogle Scholar
156.Markiewicz-Keszycka M, Czyzak-Runowska G, Lipinska P, Wojtowski J. Fatty acid profile of milk – a review. Bull Vet Inst Pulawy. 2013; 57:135. CrossrefGoogle Scholar
157.Mansson HL. Fatty acids in bovine milk fat. Food Nutr Res. 2008; 52:1, 1821. doi: 10.3402/fnr.v52i0.1821. Google Scholar
158.Ran-Ressler RR, Bae S, Lawrence P, Wang DH, Brenna JT. Branched-chain fatty acid content of foods and estimated intake in the USA. Br J Nutr. 2014; 112:565–572. doi: 10.1017/S0007114514001081. CrossrefMedlineGoogle Scholar
159.Hommelberg PP, Plat J, Langen RC, Schols AM, Mensink RP. Fatty acid-induced NF-kappaB activation and insulin resistance in skeletal muscle are chain length dependent. Am J Physiol Endocrinol Metab. 2009; 296:E114–E120. doi: 10.1152/ajpendo.00436.2007. CrossrefMedlineGoogle Scholar
160.Montgomery MK, Osborne B, Brown SH, Small L, Mitchell TW, Cooney GJ, Turner N. Contrasting metabolic effects of medium- versus long-chain fatty acids in skeletal muscle. J Lipid Res. 2013; 54:3322–3333. doi: 10.1194/jlr.M040451. CrossrefMedlineGoogle Scholar
161.Turner N, Hariharan K, TidAng J, Frangioudakis G, Beale SM, Wright LE, Zeng XY, Leslie SJ, Li JY, Kraegen EW, Cooney GJ, Ye JM. Enhancement of muscle mitochondrial oxidative capacity and alterations in insulin action are lipid species dependent: potent tissue-specific effects of medium-chain fatty acids. Diabetes. 2009; 58:2547–2554. doi: 10.2337/db09-0784. CrossrefMedlineGoogle Scholar
162.Chamma CM, Bargut TC, Mandarim-de-Lacerda CA, Aguila MB. A rich medium-chain triacylglycerol diet benefits adiposity but has adverse effects on the markers of hepatic lipogenesis and beta-oxidation. Food Funct. 2017; 8:778–787. doi: 10.1039/c6fo01663d. CrossrefMedlineGoogle Scholar
163.Bedi S, Hines GV, Lozada-Fernandez VV, de Jesus Piva C, Kaliappan A, Rider SD, Hostetler HA. Fatty acid binding profile of the liver X receptor α. J Lipid Res. 2017; 58:393–402. doi: 10.1194/jlr.M072447. CrossrefMedlineGoogle Scholar
164.Mozaffarian D. Natural trans fat, dairy fat, partially hydrogenated oils, and cardiometabolic health: the Ludwigshafen Risk and Cardiovascular Health Study. Eur Heart J. 2016; 37:1079–1081. doi: 10.1093/eurheartj/ehv595. CrossrefMedlineGoogle Scholar
165.Chan KL, Pillon NJ, Sivaloganathan DM, Costford SR, Liu Z, Théret M, Chazaud B, Klip A. Palmitoleate reverses high fat-induced proinflammatory macrophage polarization via AMP-activated protein kinase (AMPK). J Biol Chem. 2015; 290:16979–16988. doi: 10.1074/jbc.M115.646992. CrossrefMedlineGoogle Scholar
166.Duckett SK, Volpi-Lagreca G, Alende M, Long NM. Palmitoleic acid reduces intramuscular lipid and restores insulin sensitivity in obese sheep. Diabetes Metab Syndr Obes. 2014; 7:553–563. doi: 10.2147/DMSO.S72695. CrossrefMedlineGoogle Scholar
167.de Souza CO, Teixeira AAS, Biondo LA, Lima Junior EA, Batatinha HAP, Rosa Neto JC. Palmitoleic acid improves metabolic functions in fatty liver by PPARα-dependent AMPK activation. J Cell Physiol. 2017; 232:2168–2177. doi: 10.1002/jcp.25715. CrossrefMedlineGoogle Scholar
168.Souza CO, Teixeira AA, Lima EA, Batatinha HA, Gomes LM, Carvalho-Silva M, Mota IT, Streck EL, Hirabara SM, Rosa Neto JC. Palmitoleic acid (n-7) attenuates the immunometabolic disturbances caused by a high-fat diet independently of PPARα. Mediators Inflamm. 2014; 2014:582197. doi: 10.1155/2014/582197. CrossrefMedlineGoogle Scholar
169.Talbot NA, Wheeler-Jones CP, Cleasby ME. Palmitoleic acid prevents palmitic acid-induced macrophage activation and consequent p38 MAPK-mediated skeletal muscle insulin resistance. Mol Cell Endocrinol. 2014; 393:129–142. doi: 10.1016/j.mce.2014.06.010. CrossrefMedlineGoogle Scholar
170.Bernstein AM, Roizen MF, Martinez L. Purified palmitoleic acid for the reduction of high-sensitivity C-reactive protein and serum lipids: a double-blinded, randomized, placebo controlled study. J Clin Lipidol. 2014; 8:612–617. doi: 10.1016/j.jacl.2014.08.001. CrossrefMedlineGoogle Scholar
171.Kraft J, Jetton T, Satish B, Gupta D. Dairy-derived bioactive fatty acids improve pancreatic ß-cell function. FASEB J. 2015; 29:608.25. Google Scholar
172.Mozaffarian D, Wu JH. Omega-3 fatty acids and cardiovascular disease: effects on risk factors, molecular pathways, and clinical events. J Am Coll Cardiol. 2011; 58:2047–2067. doi: 10.1016/j.jacc.2011.06.063. CrossrefMedlineGoogle Scholar
173.Hodson L, Eyles HC, McLachlan KJ, Bell ML, Green TJ, Skeaff CM. Plasma and erythrocyte fatty acids reflect intakes of saturated and n-6 PUFA within a similar time frame. J Nutr. 2014; 144:33–41. doi: 10.3945/jn.113.183749. CrossrefMedlineGoogle Scholar
174.Pfeuffer M, Jaudszus A. Pentadecanoic and heptadecanoic acids: multifaceted odd-chain fatty acids. Adv Nutr. 2016; 7:730–734. doi: 10.3945/an.115.011387. CrossrefMedlineGoogle Scholar
175.Arranz E, Corredig M. Invited review: milk phospholipid vesicles, their colloidal properties, and potential as delivery vehicles for bioactive molecules. J Dairy Sci. 2017; 100:4213–4222. doi: 10.3168/jds.2016-12236. CrossrefMedlineGoogle Scholar
176.Chung RW, Kamili A, Tandy S, Weir JM, Gaire R, Wong G, Meikle PJ, Cohn JS, Rye KA. Dietary sphingomyelin lowers hepatic lipid levels and inhibits intestinal cholesterol absorption in high-fat-fed mice. PLoS One. 2013; 8:e55949. doi: 10.1371/journal.pone.0055949. CrossrefMedlineGoogle Scholar
177.Kamili A, Wat E, Chung RW, Tandy S, Weir JM, Meikle PJ, Cohn JS. Hepatic accumulation of intestinal cholesterol is decreased and fecal cholesterol excretion is increased in mice fed a high-fat diet supplemented with milk phospholipids. Nutr Metab (Lond). 2010; 7:90. doi: 10.1186/1743-7075-7-90. CrossrefMedlineGoogle Scholar
178.Wat E, Tandy S, Kapera E, Kamili A, Chung RW, Brown A, Rowney M, Cohn JS. Dietary phospholipid-rich dairy milk extract reduces hepatomegaly, hepatic steatosis and hyperlipidemia in mice fed a high-fat diet. Atherosclerosis. 2009; 205:144–150. doi: 10.1016/j.atherosclerosis.2008.12.004. CrossrefMedlineGoogle Scholar
179.Snow DR, Ward RE, Olsen A, Jimenez-Flores R, Hintze KJ. Membrane-rich milk fat diet provides protection against gastrointestinal leakiness in mice treated with lipopolysaccharide. J Dairy Sci. 2011; 94:2201–2212. doi: 10.3168/jds.2010-3886. CrossrefMedlineGoogle Scholar
180.Rosqvist F, Smedman A, Lindmark-Månsson H, Paulsson M, Petrus P, Straniero S, Rudling M, Dahlman I, Risérus U. Potential role of milk fat globule membrane in modulating plasma lipoproteins, gene expression, and cholesterol metabolism in humans: a randomized study. Am J Clin Nutr. 2015; 102:20–30. doi: 10.3945/ajcn.115.107045. CrossrefMedlineGoogle Scholar
181.Hjerpsted J, Leedo E, Tholstrup T. Cheese intake in large amounts lowers LDL-cholesterol concentrations compared with butter intake of equal fat content. Am J Clin Nutr. 2011; 94:1479–1484. doi: 10.3945/ajcn.111.022426. CrossrefMedlineGoogle Scholar
182.Soerensen KV, Thorning TK, Astrup A, Kristensen M, Lorenzen JK. Effect of dairy calcium from cheese and milk on fecal fat excretion, blood lipids, and appetite in young men. Am J Clin Nutr. 2014; 99:984–991. doi: 10.3945/ajcn.113.077735. CrossrefMedlineGoogle Scholar
183.Guidelines for the Evaluation of Probiotics in Food. Report of a Joint FAO/WHO Working Group on Drafting Guidelines for the Evaluation of Probiotics in Food. London, Ontario. 2002. http://www.who.int/foodsafety/fs_management/en/probiotic_guidelines.pdf.Google Scholar
184.Kim DH, Kim H, Jeong D, Kang IB, Chon JW, Kim HS, Song KY, Seo KH. Kefir alleviates obesity and hepatic steatosis in high-fat diet-fed mice by modulation of gut microbiota and mycobiota: targeted and untargeted community analysis with correlation of biomarkers. J Nutr Biochem. 2017; 44:35–43. doi: 10.1016/j.jnutbio.2017.02.014. CrossrefMedlineGoogle Scholar
185.Singh S, Sharma RK, Malhotra S, Pothuraju R, Shandilya UK. Lactobacillus rhamnosus NCDC17 ameliorates type-2 diabetes by improving gut function, oxidative stress and inflammation in high-fat-diet fed and streptozotocintreated rats. Benef Microbes. 2017; 8:243–255. doi: 10.3920/BM2016.0090. CrossrefMedlineGoogle Scholar
186.Gerritsen J, Smidt H, Rijkers GT, de Vos WM. Intestinal microbiota in human health and disease: the impact of probiotics. Genes Nutr. 2011; 6:209–240. doi: 10.1007/s12263-011-0229-7. CrossrefMedlineGoogle Scholar
187.de Moreno de Leblanc A, Perdigon G. The application of probiotic fermented milks in cancer and intestinal inflammation. Proc Nutr Soc. 2010; 69:421–428. CrossrefMedlineGoogle Scholar
188.Veiga P, Gallini CA, Beal C, Michaud M, Delaney ML, DuBois A, Khlebnikov A, van Hylckama Vlieg JE, Punit S, Glickman JN, Onderdonk A, Glimcher LH, Garrett WS. Bifidobacterium animalis subsp. lactis fermented milk product reduces inflammation by altering a niche for colitogenic microbes. Proc Natl Acad Sci USA. 2010; 107:18132–18137. CrossrefMedlineGoogle Scholar
189.Bron PA, Kleerebezem M, Brummer RJ, Cani PD, Mercenier A, MacDonald TT, Garcia-Ródenas CL, Wells JM. Can probiotics modulate human disease by impacting intestinal barrier function? Br J Nutr. 2017; 117:93–107. doi: 10.1017/S0007114516004037. CrossrefMedlineGoogle Scholar
190.Shirouchi B, Nagao K, Umegatani M, Shiraishi A, Morita Y, Kai S, Yanagita T, Ogawa A, Kadooka Y, Sato M. Probiotic Lactobacillus gasseri SBT2055 improves glucose tolerance and reduces body weight gain in rats by stimulating energy expenditure. Br J Nutr. 2016; 116:451–458. doi: 10.1017/S0007114516002245. CrossrefMedlineGoogle Scholar
191.Yadav H, Lee JH, Lloyd J, Walter P, Rane SG. Beneficial metabolic effects of a probiotic via butyrate-induced GLP-1 hormone secretion. J Biol Chem. 2013; 288:25088–25097. doi: 10.1074/jbc.M113.452516. CrossrefMedlineGoogle Scholar
192.Barrett HL, Dekker Nitert M, Conwell LS, Callaway LK. Probiotics for preventing gestational diabetes. Cochrane Database Syst Rev. 2014:Cd009951. MedlineGoogle Scholar
193.Jung SP, Lee KM, Kang JH, Yun SI, Park HO, Moon Y, Kim JY. Effect of Lactobacillus gasseri BNR17 on overweight and obese adults: a randomized, double-blind clinical trial. Korean J Fam Med. 2013; 34:80–89. doi: 10.4082/kjfm.2013.34.2.80. CrossrefMedlineGoogle Scholar
194.Kadooka Y, Sato M, Imaizumi K, Ogawa A, Ikuyama
K, Akai Y, Okano M, Kagoshima M, Tsuchida T. Regulation of abdominal adiposity by probiotics (Lactobacillus gasseri SBT2055) in adults with obese tendencies in a randomized controlled trial. Eur J Clin Nutr. 2010; 64:636–643. doi: 10.1038/ejcn.2010.19. CrossrefMedlineGoogle Scholar
195.Kadooka Y, Sato M, Ogawa A, Miyoshi M, Uenishi H, Ogawa H, Ikuyama K, Kagoshima M, Tsuchida T. Effect of Lactobacillus gasseri SBT2055 in fermented milk on abdominal adiposity in adults in a randomised controlled trial. Br J Nutr. 2013; 110:1696–1703. doi: 10.1017/S0007114513001037. CrossrefMedlineGoogle Scholar
196.Mozaffarian D, Hao T, Rimm EB, Willett WC, Hu FB. Changes in diet and lifestyle and long-term weight gain in women and men. N Engl J Med. 2011; 364:2392–2404. doi: 10.1056/NEJMoa1014296. CrossrefMedlineGoogle Scholar
197.Park DY, Ahn YT, Park SH, Huh CS, Yoo SR, Yu R, Sung MK, McGregor RA, Choi MS. Supplementation of Lactobacillus curvatus HY7601 and Lactobacillus plantarum KY1032 in diet-induced obese mice is associated with gut microbial changes and reduction in obesity. PLoS One. 2013; 8:e59470. doi: 10.1371/journal.pone.0059470. CrossrefMedlineGoogle Scholar
198.Poutahidis T, Kleinewietfeld M, Smillie C, Levkovich T, Perrotta A, Bhela S, Varian BJ, Ibrahim YM, Lakritz JR, Kearney SM, Chatzigiagkos A, Hafler DA, Alm EJ, Erdman SE. Microbial reprogramming inhibits Western diet-associated obesity. PLoS One. 2013; 8:e68596. doi: 10.1371/journal.pone.0068596. CrossrefMedlineGoogle Scholar
199.Power SE, O’Toole PW, Stanton C, Ross RP, Fitzgerald GF. Intestinal microbiota, diet and health. Br J Nutr. 2014; 111:387–402. doi: 10.1017/S0007114513002560. CrossrefMedlineGoogle Scholar
200.Sanchez M, Darimont C, Drapeau V, et al.. Effect of Lactobacillus rhamnosus CGMCC1.3724 supplementation on weight loss and maintenance in obese men and women. Br J Nutr. 2014; 111:1507–1519. doi: 10.1017/S0007114513003875. CrossrefMedlineGoogle Scholar
201.Sharafedtinov KK, Plotnikova OA, Alexeeva RI, Sentsova TB, Songisepp E, Stsepetova J, Smidt I, Mikelsaar M. Hypocaloric diet supplemented with probiotic cheese improves body mass index and blood pressure indices of obese hypertensive patients–a randomized double-blind placebo-controlled pilot study. Nutr J. 2013; 12:138. doi: 10.1186/1475-2891-12-138. CrossrefMedlineGoogle Scholar
202.Smith JD, Hou T, Ludwig DS, Rimm EB, Willett W, Hu FB, Mozaffarian D. Changes in intake of protein foods, carbohydrate amount and quality, and long-term weight change: results from 3 prospective cohorts. Am J Clin Nutr. 2015; 101:1216–1224. doi: 10.3945/ajcn.114.100867. CrossrefMedlineGoogle Scholar
203.Wang H, Troy LM, Rogers GT, Fox CS, McKeown NM, Meigs JB, Jacques PF. Longitudinal association between dairy consumption and changes of body weight and waist circumference: the Framingham Heart Study. Int J Obes (Lond). 2014; 38:299–305. doi: 10.1038/ijo.2013.78. CrossrefMedlineGoogle Scholar
204.Vermeer C. Vitamin K: the effect on health beyond coagulation – an overview. Food Nutr Res. 2012; 56. CrossrefMedlineGoogle Scholar
205.Walther B, Karl JP, Booth SL, Boyaval P. Menaquinones, bacteria, and the food supply: the relevance of dairy and fermented food products to vitamin K requirements. Adv Nutr. 2013; 4:463–473. doi: 10.3945/an.113.003855. CrossrefMedlineGoogle Scholar
206.Kanazawa I. Osteocalcin as a hormone regulating glucose metabolism. World J Diabetes. 2015; 6:1345–1354. doi: 10.4239/wjd.v6.i18.1345. CrossrefMedlineGoogle Scholar
207.Choi HJ, Yu J, Choi H, An JH, Kim SW, Park KS, Jang HC, Kim SY, Shin CS. Vitamin K2 supplementation improves insulin sensitivity via osteocalcin metabolism: a placebo-controlled trial. Diabetes Care. 2011; 34:e147. doi: 10.2337/dc11-0551. CrossrefMedlineGoogle Scholar
208.Rasekhi H, Karandish M, Jalali MT, Mohammad-Shahi M, Zarei M, Saki A, Shahbazian H. The effect of vitamin K1 supplementation on sensitivity and insulin resistance via osteocalcin in prediabetic women: a double-blind randomized controlled clinical trial. Eur J Clin Nutr. 2015; 69:891–895. doi: 10.1038/ejcn.2015.17. CrossrefMedlineGoogle Scholar
209.Kumar R, Binkley N, Vella A. Effect of phylloquinone supplementation on glucose homeostasis in humans. Am J Clin Nutr. 2010; 92:1528–1532. doi: 10.3945/ajcn.2010.30108. CrossrefMedlineGoogle Scholar
210.Manna P, Kalita J. Beneficial role of vitamin K supplementation on insulin sensitivity, glucose metabolism, and the reduced risk of type 2 diabetes: a review. Nutrition. 2016; 32:732–739. doi: 10.1016/j.nut.2016.01.011. CrossrefMedlineGoogle Scholar
211.Gundberg CM, Lian JB, Booth SL. Vitamin K-dependent carboxylation of osteocalcin: friend or foe? Adv Nutr. 2012; 3:149–157. doi: 10.3945/an.112.001834. CrossrefMedlineGoogle Scholar
212.Scheiber D, Veulemans V, Horn P, Chatrou ML, Potthoff SA, Kelm M, Schurgers LJ, Westenfeld R. High-dose menaquinone-7 supplementation reduces cardiovascular calcification in a murine model of extraosseous calcification. Nutrients. 2015; 7:6991–7011. doi: 10.3390/nu7085318. CrossrefMedlineGoogle Scholar
213.Schurgers LJ, Spronk HM, Soute BA, Schiffers PM, DeMey JG, Vermeer C. Regression of warfarin-induced medial elastocalcinosis by high intake of vitamin K in rats. Blood. 2007; 109:2823–2831. doi: 10.1182/blood-2006-07-035345. MedlineGoogle Scholar
214.Spronk HM, Soute BA, Schurgers LJ, Thijssen HH, De Mey JG, Vermeer C. Tissue-specific utilization of menaquinone-4 results in the prevention of arterial calcification in warfarin-treated rats. J Vasc Res. 2003; 40:531–537. doi: 10.1159/000075344. CrossrefMedlineGoogle Scholar
215.Schurgers LJ, Vermeer C. Differential lipoprotein transport pathways of K-vitamins in healthy subjects. Biochim Biophys Acta. 2002; 1570:27–32. CrossrefMedlineGoogle Scholar
216.Schurgers LJ, Teunissen KJ, Hamulyák K, Knapen MH, Vik H, Vermeer C. Vitamin K-containing dietary supplements: comparison of synthetic vitamin K1 and natto-derived menaquinone-7. Blood. 2007; 109:3279–3283. doi: 10.1182/blood-2006-08-040709. CrossrefMedlineGoogle Scholar
217.Beulens JW, Bots ML, Atsma F, Bartelink ML, Prokop M, Geleijnse JM, Witteman JC, Grobbee DE, van der Schouw YT. High dietary menaquinone intake is associated with reduced coronary calcification. Atherosclerosis. 2009; 203:489–493. doi: 10.1016/j.atherosclerosis.2008.07.010. CrossrefMedlineGoogle Scholar
218.Geleijnse JM, Vermeer C, Grobbee DE, Schurgers LJ, Knapen MH, van der Meer IM, Hofman A, Witteman JC. Dietary intake of menaquinone is associated with a reduced risk of coronary heart disease: the Rotterdam study. J Nutr. 2004; 134:3100–3105. CrossrefMedlineGoogle Scholar
219.Gast GC, de Roos NM, Sluijs I, Bots ML, Beulens JW, Geleijnse JM, Witteman JC, Grobbee DE, Peeters PH, van der Schouw YT. A high menaquinone intake reduces the incidence of coronary heart disease. Nutr Metab Cardiovasc Dis. 2009; 19:504–510. doi: 10.1016/j.numecd.2008.10.004. CrossrefMedlineGoogle Scholar
220.Chen M, Pan A, Malik VS, Hu FB. Effects of dairy intake on body weight and fat: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2012; 96:735–747. doi: 10.3945/ajcn.112.037119. CrossrefMedlineGoogle Scholar
221.Abargouei AS, Janghorbani M, Salehi-Marzijarani M, Esmaillzadeh A. Effect of dairy consumption on weight and body composition in adults: a systematic review and meta-analysis of randomized controlled clinical trials. Int J Obes (Lond). 2012; 36:1485–1493. doi: 10.1038/ijo.2011.269. CrossrefMedlineGoogle Scholar
222.Scharf RJ, Demmer RT, DeBoer MD. Longitudinal evaluation of milk type consumed and weight status in preschoolers. Arch Dis Child. 2013; 98:335–340. doi: 10.1136/archdischild-2012-302941. CrossrefMedlineGoogle Scholar
223.Noel SE, Ness AR, Northstone K, Emmett P, Newby PK. Associations between flavored milk consumption and changes in weight and body composition over time: differences among normal and overweight children. Eur J Clin Nutr. 2013; 67:295–300. doi: 10.1038/ejcn.2012.123. CrossrefMedlineGoogle Scholar
224.Huh SY, Rifas-Shiman SL, Rich-Edwards JW, Taveras EM, Gillman MW. Prospective association between milk intake and adiposity in preschool-aged children. J Am Diet Assoc. 2010; 110:563–570. doi: 10.1016/j.jada.2009.12.025. CrossrefMedlineGoogle Scholar
225.Berkey CS, Rockett HR, Willett WC, Colditz GA. Milk, dairy fat, dietary calcium, and weight gain: a longitudinal study of adolescents. Arch Pediatr Adolesc Med. 2005; 159:543–550. doi: 10.1001/archpedi.159.6.543. CrossrefMedlineGoogle Scholar
226.Noel SE, Ness AR, Northstone K, Emmett P, Newby PK. Milk intakes are not associated with percent body fat in children from ages 10 to 13 years. J Nutr. 2011; 141:2035–2041. doi: 10.3945/jn.111.143420. CrossrefMedlineGoogle Scholar
227.Niinikoski H, Viikari J, Rönnemaa T, Helenius H, Jokinen E, Lapinleimu H, Routi T, Lagström H, Seppänen R, Välimäki I, Simell O. Regulation of growth of 7- to 36-month-old children by energy and fat intake in the prospective, randomized STRIP baby trial. Pediatrics. 1997; 100:810–816. CrossrefMedlineGoogle Scholar
228.Nupponen M, Pahkala K, Juonala M, Magnussen CG, Niinikoski H, Rönnemaa T, Viikari JS, Saarinen M, Lagström H, Jula A, Simell O, Raitakari OT. Metabolic syndrome from adolescence to early adulthood: effect of infancy-onset dietary counseling of low saturated fat: the Special Turku Coronary Risk Factor Intervention Project (STRIP). Circulation. 2015; 131:605–613. doi: 10.1161/CIRCULATIONAHA.114.010532. LinkGoogle Scholar
229.Soedamah-Muthu SS, Verberne LD, Ding EL, Engberink MF, Geleijnse JM. Dairy consumption and incidence of hypertension: a dose-response meta-analysis of prospective cohort studies. Hypertension. 2012; 60:1131–1137. doi: 10.1161/HYPERTENSIONAHA.112.195206. LinkGoogle Scholar
230.Hu D, Huang J, Wang Y, Zhang D, Qu Y. Dairy foods and risk of stroke: a meta-analysis of prospective cohort studies. Nutr Metab Cardiovasc Dis. 2014; 24:460–469. doi: 10.1016/j.numecd.2013.12.006. CrossrefMedlineGoogle Scholar
231.Qin LQ, Xu JY, Han SF, Zhang ZL, Zhao YY, Szeto IM. Dairy consumption and risk of cardiovascular disease: an updated meta-analysis of prospective cohort studies. Asia Pac J Clin Nutr. 2015; 24:90–100. MedlineGoogle Scholar
232.Gao D, Ning N, Wang C, Wang Y, Li Q, Meng Z, Liu Y, Li Q. Dairy products consumption and risk of type 2 diabetes: systematic review and dose-response meta-analysis. PLoS One. 2013; 8:e73965. doi: 10.1371/journal.pone.0073965. CrossrefMedlineGoogle Scholar
233.Aune D, Norat T, Romundstad P, Vatten LJ. Dairy products and the risk of type 2 diabetes: a systematic review and dose-response meta-analysis of cohort studies. Am J Clin Nutr. 2013; 98:1066–1083. doi: 10.3945/ajcn.113.059030. CrossrefMedlineGoogle Scholar
234.Sluijs I, Forouhi NG, Beulens JW, et al.; InterAct Consortium. The amount and type of dairy product intake and incident type 2 diabetes: results from the EPIC-InterAct Study. Am J Clin Nutr. 2012; 96:382–390. doi: 10.3945/ajcn.111.021907. CrossrefMedlineGoogle Scholar
235.Chen M, Sun Q, Giovannucci E, Mozaffarian D, Manson JE, Willett WC, Hu FB. Dairy consumption and risk of type 2 diabetes: 3 cohorts of US adults and an updated meta-analysis. BMC Med. 2014; 12:215. doi: 10.1186/s12916-014-0215-1. CrossrefMedlineGoogle Scholar
236.Mensink RP, Zock PL, Kester AD, Katan MB. Effects of dietary fatty acids and carbohydrates on the ratio of serum total to HDL cholesterol and on serum lipids and apolipoproteins: a meta-analysis of 60 controlled trials. Am J Clin Nutr. 2003; 77:1146–1155. CrossrefMedlineGoogle Scholar
237.Thorning TK, Bertram HC, Bonjour JP, et al.. Whole dairy matrix or single nutrients in assessment of health effects: current evidence and knowledge gaps. Am J Clin Nutr. 2017; 105:1033–1045. doi: 10.3945/ajcn.116.151548. CrossrefMedlineGoogle Scholar
238.Ericson U, Hellstrand S, Brunkwall L, Schulz CA, Sonestedt E, Wallström P, Gullberg B, Wirfält E, Orho-Melander M. Food sources of fat may clarify the inconsistent role of dietary fat intake for incidence of type 2 diabetes. Am J Clin Nutr. 2015; 101:1065–1080. doi: 10.3945/ajcn.114.103010. CrossrefMedlineGoogle Scholar
239.Diaz-Lopez A, Bullo M, Martinez-Gonzalez MA, et al.. Dairy product consumption and risk of type 2 diabetes in an elderly Spanish Mediterranean population at high cardiovascular risk. Eur J Nutr. 2016; 55:349–360. doi: 10.1007/s00394-015-0855-8. CrossrefMedlineGoogle Scholar
240.Nestel PJ, Mellett N, Pally S, Wong G, Barlow CK, Croft K, Mori TA, Meikle PJ. Effects of low-fat or full-fat fermented and non-fermented dairy foods on selected cardiovascular biomarkers in overweight adults. Br J Nutr. 2013; 110:2242–2249. doi: 10.1017/S0007114513001621. CrossrefMedlineGoogle Scholar
241.Mozaffarian D, Cao H, King IB, Lemaitre RN, Song X, Siscovick DS, Hotamisligil GS. Trans-palmitoleic acid, metabolic risk factors, and new-onset diabetes in U.S. adults: a cohort study. Ann Intern Med. 2010; 153:790–799. doi: 10.7326/0003-4819-153-12-201012210-00005. CrossrefMedlineGoogle Scholar
242.Mozaffarian D, de Oliveira Otto MC, Lemaitre RN, Fretts AM, Hotamisligil G, Tsai MY, Siscovick DS, Nettleton JA. trans-Palmitoleic acid, other dairy fat biomarkers, and incident diabetes: the Multi-Ethnic Study of Atherosclerosis (MESA). Am J Clin Nutr. 2013; 97:854–861. doi: 10.3945/ajcn.112.045468. CrossrefMedlineGoogle Scholar
243.Kratz M, Baars T, Guyenet S. The relationship between high-fat dairy consumption and obesity, cardiovascular, and metabolic disease. Eur J Nutr. 2013; 52:1–24. doi: 10.1007/s00394-012-0418-1. CrossrefMedlineGoogle Scholar
244.Kratz M, Marcovina S, Nelson JE, Yeh MM, Kowdley KV, Callahan HS, Song X, Di C, Utzschneider KM. Dairy fat intake is associated with glucose tolerance, hepatic and systemic insulin sensitivity, and liver fat but not β-cell function in humans. Am J Clin Nutr. 2014; 99:1385–1396. doi: 10.3945/ajcn.113.075457. CrossrefMedlineGoogle Scholar
245.Forouhi NG, Koulman A, Sharp SJ, et al.. Differences in the prospective association between individual plasma phospholipid saturated fatty acids and incident type 2 diabetes: the EPIC-InterAct case-cohort study. Lancet Diabetes Endocrinol. 2014; 2:810–818. doi: 10.1016/S2213-8587(14)70146-9. CrossrefMedlineGoogle Scholar
246.Khaw KT, Friesen MD, Riboli E, Luben R, Wareham N. Plasma phospholipid fatty acid concentration and incident coronary heart disease in men and women: the EPIC-Norfolk prospective study. PLoS Med. 2012; 9:e1001255. doi: 10.1371/journal.pmed.1001255. CrossrefMedlineGoogle Scholar
247.de Oliveira Otto MC, Nettleton JA, Lemaitre RN, Steffen LM, Kromhout D, Rich SS, Tsai MY, Jacobs DR, Mozaffarian D. Biomarkers of dairy fatty acids and risk of cardiovascular disease in the Multi-ethnic Study of Atherosclerosis. J Am Heart Assoc. 2013; 2:e000092. doi: 10.1161/JAHA.113.000092. LinkGoogle Scholar
248.Chowdhury R, Warnakula S, Kunutsor S, Crowe F, Ward HA, Johnson L, Franco OH, Butterworth AS, Forouhi NG, Thompson SG, Khaw KT, Mozaffarian D, Danesh J, Di Angelantonio E. Association of dietary, circulating, and supplement fatty acids with coronary risk: a systematic review and meta-analysis. Ann Intern Med. 2014; 160:398–406. doi: 10.7326/M13-1788. CrossrefMedlineGoogle Scholar
249.Yakoob MY, Shi P, Hu FB, Campos H, Rexrode KM, Orav EJ, Willett WC, Mozaffarian D. Circulating biomarkers of dairy fat and risk of incident stroke in U.S. men and women in 2 large prospective cohorts. Am J Clin Nutr. 2014; 100:1437–1447. doi: 10.3945/ajcn.114.083097. CrossrefMedlineGoogle Scholar
250.Mozaffarian D. Natural trans fat, dairy fat, partially hydrogenated oils, and cardiometabolic health – the Ludwigshafen Risk and Cardiovascular Health Study Eur Heart J. 2016; 37:1079–1081. doi: 10.1093/eurheartj/ehv595. CrossrefMedlineGoogle Scholar
251.Kawser Hossain M, Abdal Dayem A, Han J, Yin Y, Kim K, Kumar Saha S, Yang GM, Choi HY, Cho SG. Molecular mechanisms of the anti-obesity and anti-diabetic properties of flavonoids. Int J Mol Sci. 2016; 17:569. doi: 10.3390/ijms17040569. CrossrefMedlineGoogle Scholar
252.Manach C, Williamson G, Morand C, Scalbert A, Rémésy C. Bioavailability and bioefficacy of polyphenols in humans. I. Review of 97 bioavailability studies. Am J Clin Nutr. 2005; 81:230S–242S. CrossrefMedlineGoogle Scholar



