Urticaria, angioedema, anafilaxia
Szerző: Dr. Krkos Károly
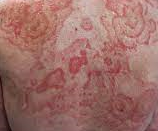
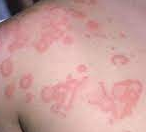
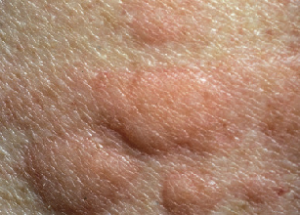
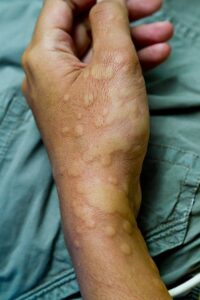
Az urtica a bőr szintjéből kiemelkedő, körülírt, erősen viszkető erythemás bőrelváltozás, melyre, ha üveglapot nyomunk, elhalványodik1-3. Legtöbbször nem magányosan fordul elő (urticaria) (1. ábra). Az egyedi elváltozások gyorsan eltűnhetnek, majd egy másik területen új léziók jelennek meg. Az állapotot akut urticariának nevezik, ha 6 hétnél rövidebb ideig marad fenn, ha 6 hétnél tovább tart, a krónikus urticaria (CU) nevet kapja. A kiváltó ok felderítéséhez kérdezni/ vizsgálni szükséges a következőket3:
• jelenlegi betegség (láz, torokfájás, köhögés, orrfolyás, hányinger, hányás, fejfájás),
• alkalmazott gyógyszerek [penicillinek, cefalosporinok, vancomycine, isoniazid, szulfa-származékok (sulfamethoxazole, sulfacetamide, sulfadiazine, sulfasalazine), diuretiukumok, NSAIDs, jodidok, bromidok, quinidine, chloroquine stb.]
• intravénás jódos kontrasztanyagok
• paraziták (amoebiais, ascariasis, strongyloidiasis, trichinosis, malaria)
• ételek (tenger gyümölcsei, tojás, sajt, csokoládé, olajos magvak, bogyós gyümölcsök, paradicsom)
• új kozmetikumok,
• új házi kedvencek (kutya, macska, aranyhörcsög stb.)
• nap- vagy hideghatás
• fizikai munka, edzés
• enyhe karcolás után alakult ki (dermografizmus)
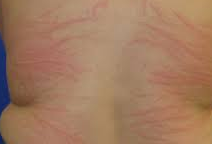
- ábra: Urticaria
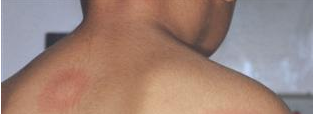
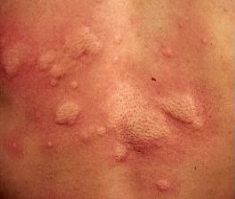
serpiginosus urticaria annularis urticaria linearis urticaria
Az akut urticaria oka lehet
• IgE-közvetítette reakció,
• kémiai anyag indukálta folyamat (non-IgE urticaria),
• autoimmun urticaria
• cholinerg urticaria,
• hideg urticaria
• mastocytosis (hízósejt betegség)
• periodikus lázzal járó szindrómák (pl. Muckle-Wells34 szindróma)
• egyéb okok
Az akut urticaria kialakulásában a következő bioaktív anyagok felszabadulása játszhat szerepet:
• hisztamin,
• bradykinin,
• leukotrién C4,
• PGD2,
• hízósejtekből, basophil leukocytákból felszabadul egyéb vazoaktív anyagok.
A kórtani folyamatokat tekintve az
• I. típusú túlérzékenység (az allergia) mellett
• a II. típusú, ellenanyag-közvetítette, citotoxikus T sejt és/vagy komplement aktiválódással, fibrin-lerakódással járó állapotok urticariás vasculitishez vezetnek, míg
• az immunkomplex képződést mutató III. típusú hiperszenzitivitás az SLE-hez és más autoimmun betegséghez társuló urticariának képezi az alapját,
• bizonyos gyógyszerek (pl. ópiátok, vecuronium, succinylcholin, vancomycin stb.) közvetlenül vagy más nem IgE mechanizmussal is képesek hízósejt- degranulációt okozni (ld. előző, „Túlérzékenység, idioszinkrázia álallergia” c. összefoglalót),
• a fizikai stimulus kiváltotta urticariák közé tartozik a nyomás, a hideg kiváltotta és a cholinerg urticaria (ez utóbbit emocionális stressz, hőhatás, fizikai megterhelés provokálhatja).
A krónikus spontán urticariák (CSU) nagy részében kiváltó ok nem mutatható ki (idiopathiás urticaria), de autológ szérum bőr teszt (ASST) pozitivitása esetén krónikus autoimmun urticaria, speciális kettősvak terheléssel (DBCT) pszeudoallergiás háttér bizonyítható1-3,5.
2. ábra: A hízósejtek aktiválódásának lehetőségei (1. és 5. irodalmi utalás alapján)
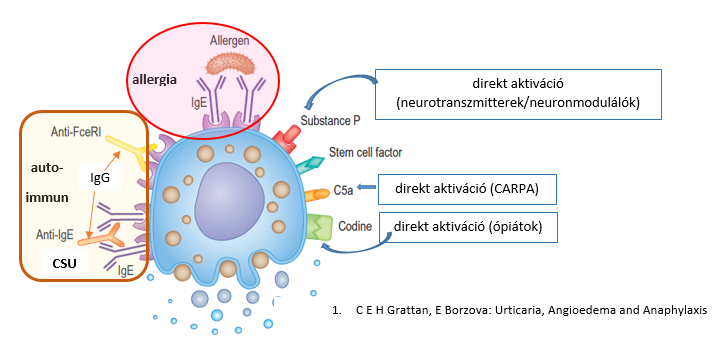
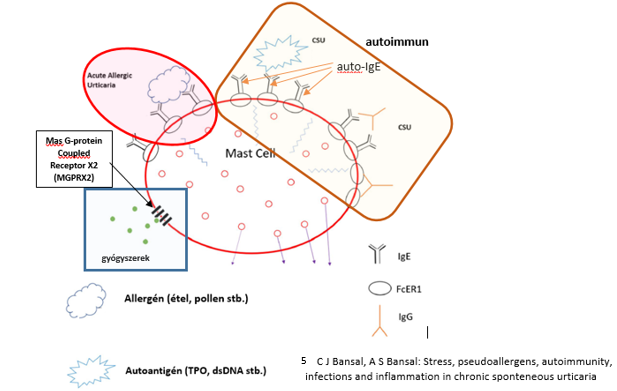
Az urticaria életet veszélyeztető folyamatot jelenthet3, ha
- az ajkakon, nyelven, gégén angioedema jelenik meg,
- ha az urticariás léziók fájdalmasak, egy helyen sokáig fennállnak (36-38 óránál hosszabban), ha körülöttük bevérzés figyelhető meg, elmúlásuk után pigmentáció vagy bevérzés látható (urticariás vasculitis vetődik fel, melyet szövettani vizsgálattal lehet igazolni),
- ha szisztémás tünetekkel társul (láz, izületi és/vagy csontfájdalom, lymphadenopathia),
- ha autoimmun pajzsmirigymegbetegedésre utaló tünetek vagy más autoimmun betegségre utaló jelek is észlelhetők,
- ha májmegnagyobbodás, sárga sclera, jobb bordaív alatti fájdalom érzékelhető,
- tüdőgyulladás vagy bronchospasmus
- bőrön gombás vagy bakteriális fertőzés jelei láthatók.
Urticariára emlékeztető bőrtünetek figyelhetők meg Schnitzler szindrómában36: bőrön rózsaszín – vörös maculák és enyhén kiemelkedő plakkok (neutrophil urticariás dermatosis) mellett monoklonális IgM szaporulat mutatható ki az alábbi tünetek közül legalább kettő kíséretében:
- láz,
- izületi- és/vagy csontfájdalom,
- megnagyobbodott nyirokcsomók, lép és/vagy máj,
- megnövekedett ESR,
- megnövekedett neutrophil leukocytaszám,
- képalkotó módszerekkel csont abnormalitások.
Jellemzi még a súlyos, gyulladással összefüggő anaemia és az amyloid A (AA) amyloidosis.
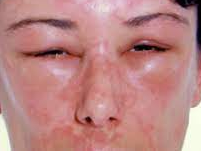
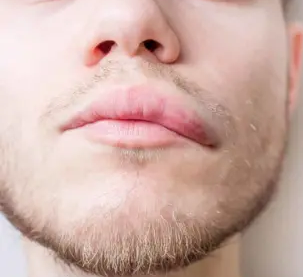
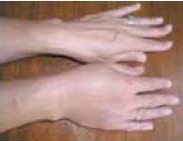
A bőralatti szövetek kifejezett (ujj-benyomatot nem tartó), hirtelen kialakuló, nem szimmetrikus ödémája az angioedema, mely jelentkezhet urticariával együtt vagy anélkül. Tipikus előfordulási helyei: arc, ajkak, nyelv, gége, genitáliák, végtagok (bár máshol is keletkezhet)6-10.
- ábra: Angioedema
3.a urticariával
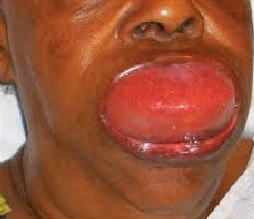
Az angioedema (AE) nemritkán életet veszélyeztető állapothoz vezet. Míg az urticariával együtt járó AE immun és a nem immun hízósejt aktiváció okozta (hisztaminerg) folyamat, a nem urticariával járó formák hátterében elsősorban a kallikrein-kinin rendszer túlzott aktivációja áll, bár néhány esetben az urticaria nélküli forma hisztaminerg hátérrel is kialakulhat1,2,4,6-10.
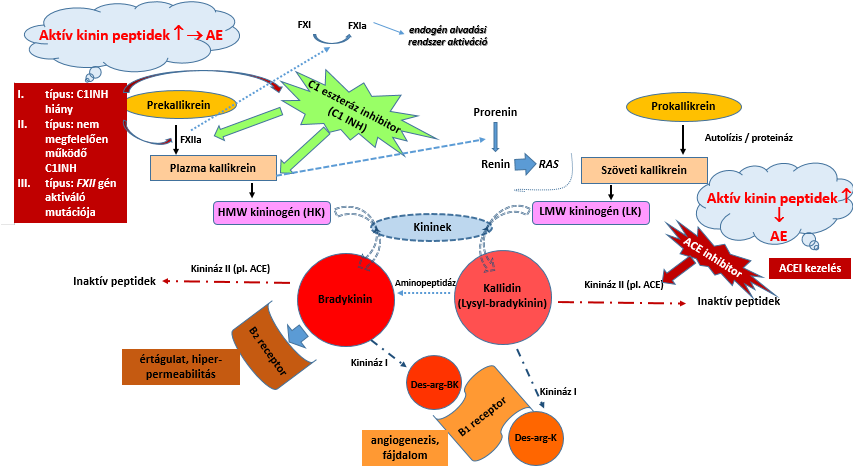
A kallikrein-kinin rendszer tagjai:
• fehérjék [nagy- és kismolekulasúlyú (HMW&LMW) kininogének]
• enzimek (plazma és szöveti kallikreinek és azok előanyagai: pre- és prokallikrein, továbbá kinináz I és az inaktíváló kininázok)
• peptidek (kininek: bradykinin, kallidin, des-arg-bradykinin és des-arg-kallidin)
• kinin receptorok (B1 és B2 receptor)
A prekallikrein aktivált XII. faktor (FXIIa) hatására alakul aktív plazma kallikrein enzimmé, mely a HMW-kininogénből (HK-ból) 9 aminosavból álló bradykinint hasítja le. A szöveti kallikrein hatására jön létre az LMWK- (vagy LK)-ból a 10 aminosavból álló kallidin. A két kinin között 1 aminosav különbség van (a kallidin egy N-terminális lizinnel több). A kallidin egy aminopeptidáz (kinináz I) hatására a lizin leszakadásával bradykininné alakul. Ez a peptid a B2 receptoron fejti ki hatását. Mindkét kininből a kinináz I enzim hatására a B1 receptoron ható des-arginin peptidek jönnek létre. Az aktív kinin peptidek inaktiválásában különböző kininázok (kinináz II) játszanak szerepet. Ilyen hatású az angiotenzin konvertáló enzim (ACE) is.
A kallikrein-kinin rendszer egyensúlyának fenntartásában a kinineket inaktíváló kininázokon túl a komplement rendszer klasszikus és lektin útját kontroláló C1 eszteráz inhibitornak (C1INH) is nagy szerep jut (a plazma kallikrein képződésének és működésének gátlásával – ld. 4. ábra).
Az angioedema veleszületett (herediter) formái (HAE) esetén vagy nem keletkezik megfelelő mennyiségű C1INH (1. típusú HAE) vagy a C1INH nem működik megfelelően (2. típusú HAE) vagy a Hageman faktor gén aktiváló mutációja miatt folytonosan keletkező XIIa „bekapcsolva tartja” a kallikrein-kinin aktivációt. Ritkábban angiopoietin 1 haploinsufficientia26 vagy az angiopoietin-1 gén (ANGPT1)27 miatt megváltozott endothel felszín aktiválja a Hageman faktort.
A C1INH elégtelenség lehet szerzett is (akvirált angioedema, AAE)1,2,4,31,32, autoimmun kórfolyamatok (pl. endothel sejtek ellen termelődött IgG Gleich szindrómában35) és rosszindulatú betegségek, miatt1,2,4,7,28 (HAE és AAE elkülönítése: 2. táblázat.)
Súlyos angioedemát okozhat adott egyénekben a vérnyomás beállítására alkalmazott ACE-inhibitor (ACE-I) kezelés. Ennek alapja, hogy az aktív kinineket inaktíváló kinináz II csoportba tartozó enzimek egyikének (ACE) blokkolása vezet a kininek felszaporodásához és okozhat angioedemát és anaphylaxist32.
4. ábra: A kallikrein-kinin rendszer működése és kapcsolata az angioedema (AE) kialakulásával11-22
1. táblázat: a veleszületett és szerzett angioedema elkülönítése laboratóriumi leletek alapján4
| C1INH szint | C1INH aktivitás | C1q szint | C4 szint | |
| 1. típusú HAE | ¯ | ¯ | norm. | ¯ |
| 2. típusú HAE | norm. | ¯ | norm. | ¯ |
| AAE | ¯ | ¯ | ¯ | ¯ |
| AE, egyéb ok miatt (nem-allergiás, idiopathiás) | norm. | norm. | norm. | norm. |
Az anafilaxia (vagy anaphylaxis) egy hirtelen kezdetű, potenciálisan életet veszélyeztető állapot, melynek fő tünetei a hörgők görcse és a szív-érrendszer működésének összeomlása mellett megjelenő urticaria, angioedema és gyomor-bélrendszeri tünetek (hányás, hasmenés)1,2,4,6-10. Megelőző jelek: tenyér, talp kivörösödése égése-viszketése, szorongás, halálfélelem, dezorientáció. A szimptómák leggyakrabban a nyálkahártyákon kezdődnek, ezt a légzési, gyomor-bélrendszeri majd a cardiovascularis jelek (tachycardia, vérnyomásesés majd bradycardia) követik, végül légzési és keringési elégtelenség következik be.
Az állapot előfordulási gyakorisága az EU-ban és az US-ban 50-103 eset/100 000 fő évente, az anafilaxiából származó halálozás 3,3/10 000 000 lakos1.
Bár az anafilaxia hátterében immun (IgE és non-IgE) és nem immun (COX-gátlás, direkt hízósejt aktiváció, kallikrein-kin rendszer fokozott működése) történések állhatnak, a lefolyás és a tünetek tekintetében nincs jelentős különbség. A különböző etiológiájú folyamatok közös következménye a számos bioaktív anyag felszabadulása, mely hörgőgörcshöz, fokozott nyákelválasztáshoz, károsodott szívizom összehúzódáshoz, az erek fokozott áteresztőképességéhez, a perifériás és szívkoszorú artériák konstrikciójához és a kis vénák tágulatához vezet.
A leggyakoribb kiváltó tényezők: ételek, gyógyszerek, rovarcsípés és a latex. Ritkábban vakcinák, aeroallergének belégzése az aktiváló tényező.. Szisztémás mastocytosisban (hízósejt betegségben) szenvedő páciensek 20%-ánál anafilaxia alakul életük során. Az ambulánsan jelentkező anafilaxiás esetek 60%-ánál, a gyermekgyógyászati esetek 20%-ánál nem sikerül kiváltó okot kimutatni. Egyre több esetben bizonyosodik be a multifaktoriális háttér. Kofaktorok csökkentik az anafilaxiás küszöböt a felnőttkori esetke mintegy 30%-ában, a rizikó magasabb b-blokkolókat, ACE-gátlókat szedők körében1,2,4,32.
Az étel indukálta anafilaxia incidenciája 0,14/100 000 fő évente, viszont 0-4 év közötti kisgyermekeknél ez 7%/év is lehet1. Vezető tünet általában a bronchospasmus és a hypoxia. Az étel, mint kiváltó tényező legtöbbször az első 10 életévben jelentkezik, viszont a tinédzser – fiatal felnőtt korban a legsúlyosabb. Ugyan bármely étel okozhat anafilaxiát, de a földimogyoró, a diófélék, halak, kagylók a leggyakrabban. Ritkán az anafilaxiát az ételfogyasztást követő fizikai megterhelés váltja ki (exercise induced anaphylaxis, EIA – pl. WDEIA – búza-függő fizikai munka kiváltotta anafilaxia – anti-ω-gliadin IgE keletkezése mellett). Szokatlan forma az α-gal (galaktóza-1,3-galaktóz) anaphylaxis, mely nem azonnal, hanem több órával az emlőshús elfogyasztása után jelentkezik – kullancs-csípést elszenvedett páciensekben2.
A gyógyszer-kiváltotta anafilaxia többségében kórházban fekvő páciensekben fordul elő, változó prevalenciával: 5-15/100 000 kórházban ápolt betegben alakul ki analgetikum vagy antibiotikum adását követően, míg ez az érték dextrán, penicillin, pentoxifyllin, streptokinase esetén meghaladja a 30/100 000-t. A gyógyszerek vezetnek a halálos kimenetelű anafilaxiás esetekben (1/50 000 – 100 000 eset), azon belül is a parenteralis adagolás jelenti a legnagyobb veszélyt.
A perioperatív anaphylaxis (1/13 000 anaesthesia) esetekben a legfőbb kiváltók a neuro-muscularis blokkolók, az antibiotikumok, a vér és vérkészítmények, a chlorhexidine és a latex. A fatális kimenetelű esetek gyakrabban fordulnak elő férfiaknál, szív-érrendszeri betegségben szenvedőknél, β-blokkolókat szedőknél.
A rovarcsípés okozta anafilaxia a gyermekek 0,4 – 0,8%-ában a felnőttek 3%-ában okozhat életet veszélyeztető reakciót, Európában 100 halálos kimenetelű esetet regisztrálnak évente. Vezető tünetek a szív-érrendszeri reakciók. A reakció súlyossága függ a rovar fajtájától, a befecskendezett méreg mennyiségétől, a csípés helyétől, a páciens életkorától, meglévő betegségeitől. Hymenoptera méreg allergia esetén allergénspecifikus immunterápia 8 hét elteltével 3-5 év hosszan biztosít védelmet az anaphylaxis ellen. Mastocytosisban szenvedő páciensekben előszöri csípés alkalmával is előfordulhat fatális kimenetel, főként ha a méreg bizonyos komponenseket (pl. foszfolipáz-A2-t, ami egy hízósejt liberátor) tartalmaz.
Anafilaxia klonális hízósejt betegség (szisztémás mastocytosis vagy monoklonális hízósejt aktivációs szindróma) esetén kiváltó tényező lehet Hymenoptera csípés, gyógyszerek (NSAIDs, ópiátok, perioperatívan adott szerek). Amennyiben egy páciensnek nem megmagyarázható anafilaxiája alakult ki, a szisztémás mastocytosist, a monoklonális hízósejt aktivációs szindrómát ki kell zárni.
Az anafilaxia ritka okai: IgA hiányos betegek transzfúzióval, vérkészítménnyel történő kezelésekor gondolni kell rá, hogy az ilyen betegek mintegy harmadánál a keringésben lévő IgA-ellenes antitestek az IgA-t tartalmazó vérkészítmény miatt életet veszélyeztető anafilaxiás reakciót válthatnak ki. Ondó okozta anafilaxia fiatal, atópiás nőkben fordulhat elő, ezek 20%-ban életet veszélyeztető lehet. Echinococcus hydatoid cystájának rupturája (műtét alatt vagy trauma miatt) szintén anafilaxiához vezethet.
Klinikai megjelenését tekintve négy formát írtak le: azonnali, kétfázisú, elnyújtott, késleltetett. A tünetek a kiváltó tényezővel találkozás után másodpercekkel megkezdődhetnek. Minél rövidebb az expozíció és a tünetek megjelenése közti idő, az anafilaxia annál súlyosabb. a kétfázisú esetekben a roham 1-72 óra múlva, de rendszerint 8-10 órán belül, újra megjelennek. Erre akkor lehet számítani, ha a kiváltó tényező ismeretlen és hypotensio van jelen. Az elhúzódó anafilaxia 24 óránál hosszabb ideig tart, gyakran terápia rezisztens. Késői kezdetű anaphylaxis rendkívül ritka. A legsúlyosabb esetekben gégeödéma, légzési elégtelenség, keringés-összeomlás alakul ki.
Irodalom
1 C E H Grattan, E Borzova: Urticaria, Angioedema and Anaphylaxis 2019 Clinical Immunology 5th Edition
DOI: 10.1016/B978-0-7020-6896-6.00042-9
2 J Pier, T A Bingemann: Urticaria, Angioedema, and Anaphylaxis, Pediatrics in Review 2020, 41(6): 283-292
Chapter 42: 585-600, https://doi.org/10.1542/pir.2019-0056
3 H K Wong: Urticaria, emedicine, 2020, https://emedicine.medscape.com/article/762917
4 C E Ciaccio: Angioedema: An Overview and Update, Missouri Medicine 2011, 108(5): 354-357,
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6188378/
5 C J Bansal, A S Bansal: Stress, pseudoallergerns, autoimmunity, infections and inflammation in chronic sponteneous urticaria
Allergy, Asthma Clin Immunol 2019 15:56, https://doi.org/10.1186/s13223-019-0372-z
6 C Scully: Angioedema in Oral and Maxillofacial Medicine (3rd edition) 2013, p220-222,
https://doi.org/10.1016/B978-0-7020-4948-4.00032-5
7 H H Lee: Agioedema, Medscape 2018, https://emedicine.medscape.com/article/135208
8 M H Ohn&R Wadhwa: Angioneurotic Edema, In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing;
2021. Jan, https://www.ncbi.nlm.nih.gov/books/NBK560611/
9 B Zurav: An overview of angioedema: Pathogenesis and causes; UpToDate 2021
https://www.uptodate.com/contents/an-overview-of-angioedema-pathogenesis-and-causes
10 B Zurav: An overview of angioedema: Clinical features, diagnosis, and management; UpToDate 2021
https://www.uptodate.com/contents/an-overview-of-angioedema-clinical-features-diagnosis-and-management
11 Ch Golias, A Charalabopuolos et al.: The kinin system – bradykinin: biological effects and clinical implications. Multiple role of
the kinin system – bradykinin; Hippokratia 2007, 11(3):124-128; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2658795/
12 H. Heiwald and W Müller-Esterl: Kinins in: S Offermans and W Rosentahl: Encyclopedic Reference of Molecular Pharmacology,
Springer-Verlag 2004 (ISBN 3-540-42843-7), p541-546
13 Bhoola, K. D., & Fink, E. (2006). KALLIKREIN–KININ CASCADE in Encyclopedia of Respiratory Medicine, 483–493.
doi:10.1016/b0-12-370879-6/00204-0
14 D J Campbell: Bradykinin and its related peptides in Handbook of Biologically Active Peptides 2006, p1175-1179
https://doi.org/10.1016/B978-012369442-3/50164-1
15 D Regoli, F Marceau: Bradykinin Receptors in: J Enna& D B Bylund: xPharm: The Comprehensive Pharmacology Reference,
Esevier 2008 (ISBN 978-0-08-055232-3), p 1-4, 10.1016/B978-008055232-3.60203-X
16 Kenne, E., Rasmuson, J., Renné, T., Vieira et al.:. (2018). Neutrophils engage the kallikrein-kinin system to open up
the endothelial barrier in acute inflammation. The FASEB Journal, doi:10.1096/fj.201801329r
17 Y Pirahanchi, s Sharma: Physiology, Bradykinin In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan.,
https://www.ncbi.nlm.nih.gov/books/NBK537187/
18 I Isordia-Salas, R A Pixley et al.: The Role of Plasma High Molecular Weight Kininogen in Experimental Intestinal and Systemic
Inflammation, Archives of Medical Research 2005, 36:87–95; doi: 10.1016/j.arcmed.2005.02.001
19 M K S Wong: Bradykinin in Handbook of Hormones 2016, Subchapter 30C 274-276
20 K Majunder & J Wu: Molecular Targets of Antihypertensive Peptides: Understanding the Mechanisms of Action Based on the
Pathophysiology of Hypertension, Int. J. Mol. Sci. 2015, 16:256-283; doi:10.3390/ijms16010256
21 A H Schmaier: The plasma kallikrein-kinin system counterbalances the renin-angiotensin system
J Clin Invest. 2002;109(8):1007–1009. https://doi.org/10.1172/JCI15490.
22 R Kahn, D Karpman: Kinin system activation in vasculitis, Acta Paediatrica 2011, 100:950-957,
DOI:10.1111/j.1651-2227.2011.02266.x
23 B Zuraw, H Farkas: Hereditary angioedema (due to C1 inhibitor deficiency): Pathogenesis and diagnosis, UpToDate
uptodate.com/contents/hereditary-angioedema-due-to-c1-inhibitor-deficiency-pathogenesis-and-diagnosis?search=hereditary
%20angioedema&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1
24 B Zuraw, H Farkas: Hereditary angioedema: Epidemiology, clinical manifestations, exacerbating factors, and prognosis
https://www.uptodate.com/contents/hereditary-angioedema-epidemiology-clinical-manifestations-exacerbating-factors-and-
prognosis?search=hereditary%20angioedema&source=search_result&selectedTitle=3~150&usage_type=default&display_rank=3
25 B Zuraw, H Farkas: Hereditary angioedema (due to C1 inhibitor deficiency): General care and long-term prophylaxis
https://www.uptodate.com/contents/hereditary-angioedema-due-to-c1-inhibitor-deficiency-general-care-and-long-term-
prophylaxis?search=hereditary%20angioedema&source=search_result&selectedTitle=5~150&usage_type=default&display_rank=5
26 M d’Apolito, R Santacroce et al: Angiopoietin‐1 haploinsufficiency affects the endothelial
barrier and causes hereditary
angioedema, Clin Exp Allergy
. 2019 May;49(5):626-635. doi: 10.1111/cea.13349.
27 V Bafunno, D Firinu et al.: Mutation of the angiopoietin-1 gene (ANGPT1) associates with a new type of hereditary angioedema
J Allergy Clin Immunol 2018, 141(3):1009-1017, http://dx.doi.org/10.1016/j.jaci.2017.05.020
28 M. Maurer, M Magerl et al.: The international WAO/EAACI guideline for the management of hereditary angioedema—
The 2017 revision and update, Allergy 2018, 73(8):1575-1596, https://doi.org/10.1111/all.13384
29 P J Busse, S C Christiansen et al.: US HAEA Medical Advisory Board 2020 Guidelines for the Management of Hereditary
Angioedema, J Allergy Clin Immunol Pract 2021, 9(1):132-50, https://doi.org/10.1016/j.jaip.2020.08.046
30 S Saini: Acquired C1 inhibitor deficiency: Clinical manifestations, epidemiology, pathogenesis, and diagnosis, UpToDate
https://www.uptodate.com/contents/acquired-c1-inhibitor-deficiency-clinical-manifestations-epidemiology-pathogenesis-and-
diagnosis?search=Acquired%20C1%20inhibitor%20deficiency&source=search_result&selectedTitle=1~32&usage_type=default
&display_rank=1
31 S Saini: Acquired C1 inhibitor deficiency: Management and prognosis, UpToDate
https://www.uptodate.com/contents/acquired-c1-inhibitor-deficiency-management-and-prognosis?search=Acquired%20C1
%20inhibitor%20deficiency&source=search_result&selectedTitle=2~32&usage_type=default&display_rank=2
32 A C Guyer, A Banerji: ACE inhibitor-induced angioedema, UpToDate
https://www.uptodate.com/contents/ace-inhibitor-induced-angioedema?search=ace%20inhibitor
%20induced%20angioedema&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1
33 D J Pearson: Psychologic and somatic interrelationships in allergy and pseudoallergy, J Allergy Clin Immunol 1986,
81(2):351-360, DOI: 10.1016/0091-6749(88)90900-1
34 R A Schwartz: Wells syndrome 2021 March, emedicine, https://emedicine.medscape.com/article/1124844-overview
35 R Haaber, J A Chebi et al.: Gleich syndrome, International Journal of Dermatology 2020, https://doi.org/10.1111/ijd.14963
36 D Lipsker: Schnitzler syndrome, Orphanet Journal of Rare Diseases 2010,5:38, http://www.ojrd.com/content/5/1/38



