Kevert IgE/non-IgE allergia
Szerző: Dr. Krkos Károly
Az előző összefoglalónkban már említést tettünk az étel-érzékenység körébe tartozó problémák felosztásáról (1. ábra) és az egyik immun-mediált betegségcsoportról (non-IgE allergiák). Ebben az írásban olyan kórállapotokat szeretnénk röviden ismertetni, melyekben az IgE termelődés fokozott, de más mechanizmusok dominálnak a betegségcsoport patogenezisében („kevert IgE/non-IgE allergia”).
- ábra: Az ételérzékenységek osztályozása

A kevert IgE/non-IgE és non-IgE allergiák diagnosztizálásában elsődleges szerepet az alapos, részletes anamnézis-felvétel játssza, melyet sok esetben képalkotó eljárásokkal, endoszkópos módszerekkel, biopsziás minták vizsgálatával szükséges kiegészíteni. Ebbe a csoportba az eozinofil gyomor-bélrendszeri betegségek (eosinophilic gastrointestinal diseases, EGID) tartoznak. A betegség lokalizációja szerint eozinofil özofagitiszt (EoE), eozinofil gasztritiszt (EG), eozinofil gasztroenteritiszt (EGE), eozinofil enteritiszt (EE) és eozinofil kolitiszt (EC) különböztetnek meg1-3,8.
Az EGID ritka betegségnek számít, prevalenciáját 22-28/100 000 főre becsülték (US)5, de a biztosítói adatok alapján ennél is kisebbnek tűnik:
- EG: 6,3/100 000 (gyermekeknél 5 évnél idősebbekben)
- EGE: 8,4/100 000 (5 év alatti gyermekekben gyakoribb)
- EC 3,3/100 000
Felnőtteknél bármely életkorban előfordulhat, de a gyakorisági csúcs 30 és 50 év közötti korosztályban figyelhető meg1-3,5.
Eozinofil gasztroenteritisz (EGE)
Patogenezise kevéssé feltárt. A páciensek 50-70%-ában az állapot atópiás betegségekkel társul1-3, továbbá EG és EGE esetén gyakori az emelkedett ételspecifikus szérum IgE szint. Bár az EG/EGE kórképekben ez az IgE szint nem mutatja meg egyértelműen a kiváltó ételt, az elementáris vagy eliminációs diéta mégis hatásos, javítja a klinikai, endoszkópos és szövettani képet. Az ilyen betegségben szenvedőkben az étel IL-5 termelő, allergén-specifikus T-helper-2 (Th2) sejtek aktiválódását váltja ki, mely a bélben az eozinofil sejtek felszaporodásához vezet. Ez utóbbiban az eozinofil sejt toborzás feladatát teljesítő kemokinek, az eotaxinok játszanak szerepet. Az eozinofilok perzisztálását az IL-3, Il-5 interleukinok és a granulocita-makrofág kolónia-stimuláló faktor (GM-CSF) biztosítja. Az eozinofilok jelenléte helyi gyulladáshoz vezet, mivel belőlük citotoxikus kationok (pl. major bázikus protein, MBP) szabadulnak ki. A Th2 citokinek (IL-4, IL-5, IL-13) és az eozinofil kemokin, az eotaxin-3 szintézise fokozódik1.
Klinikai megjelenési formáit tekintve a nyelőcsőtől a vastagbélig érintheti a gyomor-bél rendszert. Az eozinofil gasztritisz (EG) a gyomor antrum és corpus részére lokalizálódik. Az eozinofil gasztroenteritisz (EGE) tipikusan az antrum distalis, a vékonybelek proximális részét érinti. Az EG/EGE betegek 50-70%-a valamilyen atópiás betegségben (asztma, ekcéma, szénanátha) szenvednek. A tünetek nemcsak a betegség lokalizációjától függnek, hanem attól is, hogy bélrendszer mely rétegét infiltrálják az eozinofil sejtek. A nyálkahártya (mucosa) érintettsége esetén a hasi fájdalom, hányinger, hányás, korai jólakottság érzés és a hasmenés a vezető tünet. A betegek egyharmadában testsúlycsökkenés (³ 2,4 kg) észlelhető. Diffúz vékonybél érintettség malabszorpcióval, fehérjevesztő enteropátiával társul. Az izom- (muscularis) réteg betegsége a bélfal vastagodását és a motilitás károsodását eredményezi, következményes bélelzáródással, hányingerrel, hányással, puffadással jár. A nyelőcső eozinofil-sejtes gyulladása szűkülethez, nyelési nehézséghez, az emésztetlen étel regurgitációjához vezethet (pseudoachalasia). Előfordulhat a gyomorkimenet, a vékonybél, ritkán a vastagbél elzáródása vagy perforációja. A külső savós hártya alatti szövet (subserosa) betegsége vagy izoláltan hasűri folyadék (ascites) megjelenésével társul vagy emellett a mucosa és a muscularis réteg betegségére jellemző tünetek is megjelennek. Az ascitesben eozinofil sejtek láthatók.
-
- táblázat: Az EGE klinikai megjelenési formái (A A Rached, W El Haj: Eosinophilic gastroenteritis: Approach to diagnosis and management alapján – 2. irodalmi utalás)
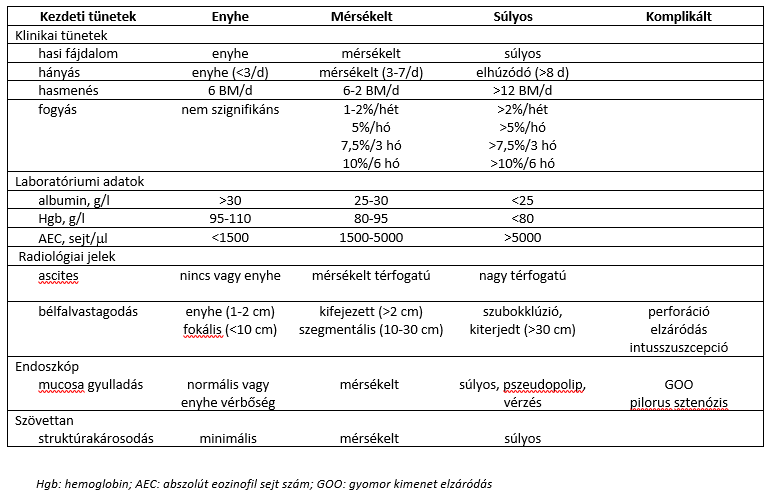
Laboratóriumi eltérések: A betegek mintegy 80%-ában az eozinofil sejtek relatív és abszolút száma emelkedett (5-35% ill. átlagosan 1000 eozinofil sejt/ml). A mucosalis és subserosalis típus magasabb eozinofil sejtszámmal jár, mint a muscularis típus1,5. Mucosalis EG/EGE esetén szénhidrát malabszorpció (kóros D-xilóz teszt), fokozott zsírürítés (a széklet zsírtartalma emelkedett), megnyúlt protrombin idő észlelhető. A nyálkahártya áteresztőképességének fokozódása fehérje-vesztő enteropátia kialakulásához vezethet, mely mellett a szérum albumin szint alacsony. A vérszegénység a károsodott vasfelszívódással és gyomor-bélrendszeri okkult vérzéssel (vashiány) áll összefüggésben. Mérsékelten fokozott vérsejtsüllyedés a betegek mintegy negyedében figyelhető meg. A szérum IgE szint emelkedett lehet (főként gyermekkori esetekben).
Az endoszkópos vizsgálat során nyálkahártya kifekélyesedés, polipok és pszeudopolipok, néha gyulladásra utaló jelek, a bélbolyhok atrófiája, nyálkahártya alatti ödéma és fibrózis figyelhető meg. Mivel a folyamat foltos megjelenésű, legalább 5-6 helyről kell mintát venni, a szövettani vizsgálatokhoz ép és kóros területekről3. Teljes szöveti vastagságú minta vétele (nem mucosalis betegség esetén) sebészi feltárásból lehetséges.
A szövettani kép értékelése alapvető fontosságú a diagnózishoz. A diagnózishoz a legfontosabb kritérium a szövetek eozinofil sejtes infiltrációja, más eozinofil sejt infiltrációt okozó betegség kizárása mellett. Fontos, hogy csak a gyomor-bél rendszer legyen érintett1,3. A nyelőcső kivételével az egész gyomor-bél traktus tartalmaz eozinofil sejteket, s az egyes szakaszok egészségesekre jellemző eozinofil sejtszámának egyértelmű meghatározása eddig még nem történt meg. A mikroszkópos értékelést mindenképpen ezen a területen kellő jártasságra szert tett patológusnak kell végeznie. M H Collins a következő kóros eozinofil sejtszám értékeket állapította meg4:
-
- gyomor: ≥30 eozinofil sejt/nagyfelbontású (400x) látótér (HPF)
-
- duodenum: ≥ 30 eozinofil sejt /HPF
-
- ileum: >56 eozinofil sejt/HPF
-
- colon ascendens: >100 eozinofil sejt /HPF
-
- colon transversum and descendens: >84 eozinofil sejt /HPF
-
- szigmabél és végbél: >64 eozinofil sejt /HPF
Képalkotó eljárások során gyomor- és/vagy bélfal vastagodás, szabálytalan bélüreg szűkület (főként a distalis antrum és a proximalis vékonybél területén). Ezek nem specifikusak a betegségre1,3. A CT felvételen a vékonybél és az ileocoecalis szakasz ödémája figyelhető meg, mely jellegzetes „halo” és „araneid limb-like” tünet formájában válik láthatóvá18 (a képek Xing Huang, Xiangqi Xiao et al: Halo sign and araneid limb sign in eosinophilic enteritis 2020, Lancet Gastroenterology and Hepatology cikke alapján készültek):
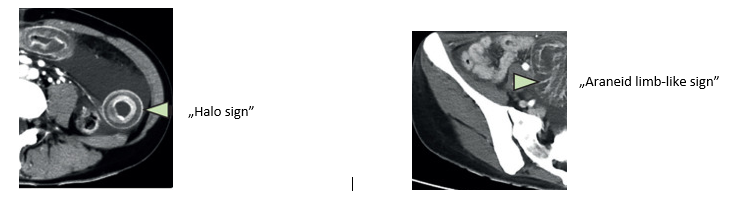
Hasi ultrahang és CT vizsgálat során kimutatható az esetleg hasűri folyadék (ascites), mely néha lokalizált nyirokcsomó megnagyobbodással társul. Ezek a tünetek Crohn betegségben, lymphomában, granulomatosus betegségekben is megfigyelhetők1,3. A „halo” és az „araneid limb-like” jel gyulladásra jellemző (és segít elkülöníteni a betegséget a daganatos folyamatoktól)3. A fehérvérsejtek 99mTc-HMPAO jelölésével készített SPECT/CT felvétel a betegség kiterjedésének megítélésében és a kezelésre adott válasz ellenőrzésében játszik szerepet3.
A fent említett diagnosztikai eljárásokat ki kell egészíteni, hogy a hasonló tüneteket mutató kórképeket el lehessen különíteni (differenciál diagnózis):
Gyógyszerek okozta eltérések: acetil-szalicilsav (ASA), szulfonamidok, penicillin, cefalosporinok, karbamazepin, azatioprin, L-triptofán, aranysók hasonló szöveti (és perifériás) eozinofiliát okozhatnak5.
Bélfertőzések: Parazitafertőzések: Ancylostoma, Anisakis, Ascaris, Strongyloides, Toxocara, Trichiuris, Capillaria, Trichinella; gombafertőzés: Basidiobolomycosis székletből vagy szerológiai vizsgálattal azonosítható. A legjobban az Ancylostoma caninum fertőzés klinikai képe tudja leutánozni az EGID-t (a bélfal eozinofil sejtes infiltrációja és ascites lakul ki)1. A székletben az eozinofil sejtek granulumaiból származó Charcot-Leyden kristályok is megtalálhatók.
Rosszindulatú betegségek: Lymphoma, gyomorrák, vastagbélrák perifériás eozinofiliával járhat, a betegség elzáródást okozhat, képalkotó vizsgálatok során bélfal vastagodás figyelhető meg. Ezeket a betegségeket endoszkópos vizsgálatokkal, a teljes falvastagságra kiterjedő biopsziás minta szövettani vizsgálatával lehet elkülöníteni.
Gyulladásos bélbetegségek (IBD): Néha a Crohn betegség és a colitis ulcerosa eozinofiliával és a gyomor-bél traktus szöveteinek eozinofil infiltrációjával járhat. Endoszkópos vizsgálat során jellemző szerkezeti torzulásokat, fokális neutrofil exudátumokat és granulomákat lehet megfigyelni.
Hipereozinofil szindróma (HES): Idiopátiás állapot, melyet nagymértékű eozinofilia (<1500 eozinofil sejt/ml, több mint 6 hónapon keresztül) jellemez. Ritkán gyomor-bélrendszeri panaszok dominálják. HES esetén azonban (az EGID-del szemben) több szerv (szív, tüdő, agy, vese) is érintett. Ha HES lehetősége merül fel hematológus, allergológus segítségét kell kérni a betegség kizárásához. Polyarteritis nodosa (PAN): Szintén eozinofiliával és hasi fájdalommal járó kórkép, amely szisztémás megjelenésű (az EGID-del ellentétben), jelentősen emelkedett vörösvértest süllyedéssel, a biopsziás mintában perivascularis eozinofil sejt szaporulattal.
Eozinofil granulomatosis polyangiitisszel (Churg-Strauss szindróma): Hasi fájdalommal, hasmenéssel, gyomor-bélrendszeri vérzéssel járó EGID megjelenhet Churg-Strauss szindróma előtt vagy azzal egyidőben. A polyangiitisszel járó eozinofil granulomatosis kardinális tünete a vaszkuláris fázis megjelenését 8-10 évvel megelőző asztma.
Eozinofil granuloma (Langerhans-sejtes histiocytosis, LCH, régi, ma már nem használatos nevei: histiocytosis-X, Letterer-Siwe betegség, Hand-Schüller-Christian kór): Az LCH egy daganatos histiocytás megbetegedés, mely leggyakrabban a csontokat és a bőrt érinti, de megjelenhet a csontvelőben, lépben, májban, tüdőben, agyalapi mirigyben, a központi idegrendszerben és más szervekben is. Elsősorban kora gyermekkorban észlelhető. A biopsziás minta granulomás megjelenése elkülöníti az EGID-től.
Kezelését jelenleg még nem alapozták meg egyértelműen és azt a tüntetek súlyossága, a felszívódási zavar megléte vagy hiánya jelentősen befolyásolja.
Étrendi beavatkozás alapja az empirikus eliminációs diéta: a hat-(szója, búza, tojás, tej, olajos magvak, halak/tenger gyümölcsei)1,3 vagy hét-(előbbi+ vörös húsok)3 étel eliminációs étrend, súlyosabb esetekben elementáris diéta (kalcium és D-vitamin pótlással)1,3. Utóbbi alkalmazásakor a betegek mintegy ¾-e remisszióba kerül, de még ez sem biztosítja, hogy a tünetek ne térjenek vissza33. Enyhe tünetekkel járó betegségben a specifikus IgE teszt alapján beállított célzott elimináció is megpróbálató3, de az enyhe lefolyású esetektől eltekintve semmilyen allergia teszt nem segít a hatásos diéta összeállításában1. Az étrendi kezelés hatékonyságát legkifejezettebben mucosalis típusú EGE kapcsán észlelték31, a muscularis és a subserosalis betegség kevésbé ételallergia függő32. Az étrendi kezelés hatékonyságát jelzi, ha a vérben az eozinofil sejtek száma 4-6 héten belül legalább felére csökken5.
Gyógyszeres kezelés szükséges. Első helyen a szteroidok szerepelnek. Kezdeti terápiaként prednizolont 6-8 hétig, napi 30-40 mg dózisban alkalmazva, az esetek több mint 90 %-ában remissziót eredményez, viszont a gyógyszer dózisának fokozatos csökkentése gyakran a tünetek kiújulásához vezet, ilyenkor napi 1-10 mg-os fenntartó kezelést állítanak be, vagy a prednizolont budezonidra cserélik. Utóbbi előnye, hogy lassú felszívódású enteralis kapszula formájában adva kevesebb mellékhatást vált ki. A kezelést kiegészíthetik az asztma kezelésében is használt leukotrién-receptor antagonistával (montelukast sodium), hízósejt stabilizálóval [sodium cromoglycate (cromolyn, SCG)] és második generációs antihisztaminnal (ketotifen), immunmodulátorokkal (azatioprin, 6-merkaptopurin), proton-pumpa inhibitorokkal. Az utóbbi években új, biológiai kezelésekkel (reslizumab – IL-5 antitest, infliximab – TNFa antitest, omalizumab – anti-IgE, suplatast tosilate – szelektív Th2 citokin inhibitor), intravénás immunglobulin kezeléssel, α-interferon (IFNα) adással és széklet mikrobiota transzplantációval is próbálkoznak3.
Sebészi kezelést kell alkalmazni perforáció, intusszuszcepció, bélelzáródás esetén.
-
- ábra: Az EGE kivizsgálási algoritmusa (A A Rached, W El Haj: Eosinophilic gastroenteritis: Approach to diagnosis and management alapján – 2. irodalmi utalás)
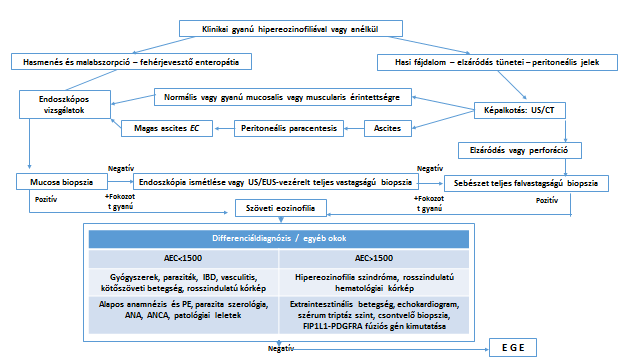
AEC: abszolút eozinofil sejt szám; EC: eozinofil sejt szám; US: ultrahang vizsgálat; PE: fizikális vizsgálat
A betegség lefolyása krónikus, hullámzó, de prognózisa jó, talaján rosszindulatú daganat nem fejlődik ki1,3.
Eozinofil özofagitisz (EoE)
A betegség a nyelőcsőre lokalizálódik. A tünetek gasztroözofageális reflux betegségre emlékeztetnek, de annak szokásos (gyógyszeres és sebészi) kezelését alkalmazva az állapot nem javul6-8. A diagnózis alapja a klinikai kép mellett a nyelőcső biopsziás minta vizsgálata. Nagy nagyítású látóterenként >15 eozinofil sejt látható4,6-8, és az eozinofilia egyéb okai kizárhatók6-8.
Patogenezisében környezeti tényezők (születés császármetszéssel, koraszülés, antibiotikus kezelés a csecsemőkor alatt, ételallergia, az anyatejes táplálás hiánya, atópiás betegségek, megváltozott mikrobiom), a genetikai hajlam (a csecsemőmirigy stromális limfopoietin –TSLP, az eotaxin-3, a kalpain-14 génje), a károsodott barrier funkció (filaggrin, zonulin-1, dezmoglein-1 alultermelődés), a barrier funkció romlása (megnövekedett intercelluláris tér), a megnövekedett Th2 aktivitás, eozinofil-, bazofil-sejt, hízósejt és NK-sejt toborzás játszanak szerepet. Megfigyelhető a négy leggyakoribb allergén étel ellen termelődött IgG4 jelenléte a nyelőcső epitheliumában7. Az IgE-teszt nem ad segítséget a kiváltó ételek felfedésében6-8. A nyelőcsövön koncentrikus gyűrűk, barázdák, tágult és szűkült szakaszok jelennek meg, mely a krónikus gyulladás talaján kialakult fibrózissal hozhatók összefüggésbe (ld. 2. ábra)
-
- ábra: Eozinofil özofagitisz kórtana (G T Furuta: Eosinophilic Esophagitis– 7. irodalmi utalás alapján)
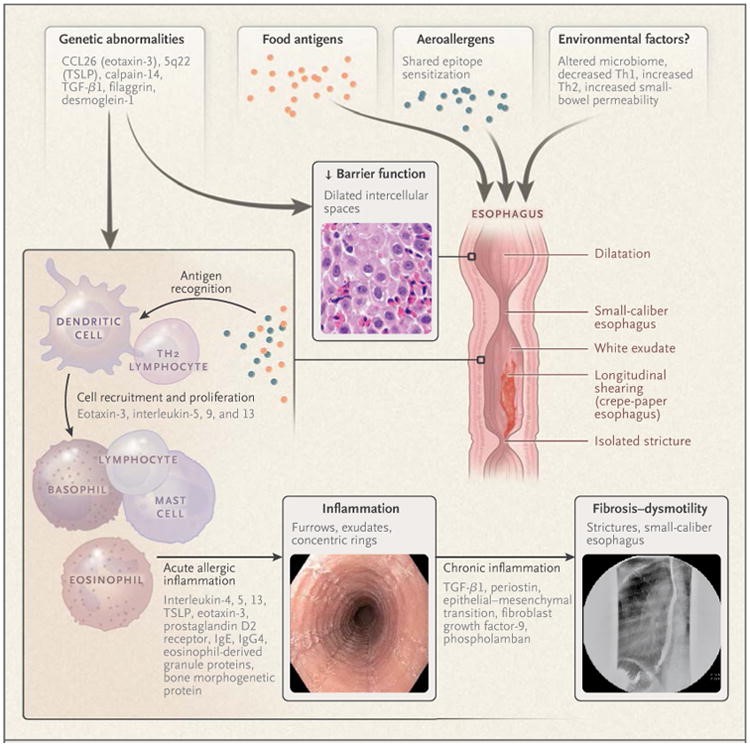
A klinikai képet gyermekkorban a táplálási nehézségek, hányinger, hányás, hasfájás, fejlődés elmaradás jellemzi. Tinédzser és felnőttkorban a nyelési nehézség, az étel elakadása, antacidra nem javuló mellkasfájdalom, krónikus reflux a vezető tünet6-8. Ritkán a nyelőcső szakadása is bekövetkezhet az erőteljes öklendezéstől (Boerhaave szindróma).
Három altípusát írták le6:
-
- EoEe1 – enyhe alcsoport: egészségesnek tűnő nyelőcső, enyhe szövettani, endoszkópos és molekuláris eltéréssel
-
- EoEe2 – gyulladásos endotípus: gyulladásos citokinek expressziója fokozott, szteroidra reagáló és szteroid refrakter fenotípussal
-
- EoE3 – fibrostenoticus endotípus. szűk kaliberű nyelőcső, súlyos kóros endoszkópos képpel és szövettani eltérésekkel, csökkent epithelium differenciációs génekkel.
Az endoszkópos vizsgálat során fehér exsudatumok, nyálkahártya ödéma, lineáris barázdák, nyelőcső gyűrűk és szűkületek figyelhetők meg. A krónikus átépülés miatt „krepp papír nyelőcső” alakul ki. Az értékeléshez validált endoszkópos pontrendszert dolgoztak ki (edema, rings, exudates, furrows and strictures scores – EREFS). Legalább 4-5 helyről tanácsos biopsziás mintát venni a vizsgálat során6-8.
A szűkületek megítélésére – melyek gyakran nem észlelhetők endoszkópos vizsgálat során – legalkalmasabb a bárium kontrasztanyagos röntgenvizsgálat.
A szövettani vizsgálat az EoE esetén is alapvető a diagnózis megállapításához. Jellemzői a szöveti eozinofilián (>15 eozinofil sejt/nagy nagyítású látótér) kívül: enyhe-mérsékelt bazális sejt hiperplázia, a vaszkuláris papillák elongációja, a tág intercelluláris terek, az intraepithelialis limfocitózis.
Az étrendi és gyógyszeres kezelés hasonlóan az EGE fejezetben leírtakhoz elementáris vagy 6-étal eliminációs diéta, ill. szteroidok (prednizolon, budezonid)6-8. Újabban biológiai terápiák bevezetésével is próbálkoznak8. Proton pumpa gátlók adását is javasolják, bár ezekre sok esetben a reflux tünetei nem szűnnek meg, de csökkentik a citokin termelődést (a gyomorsav szekréció csökkentése mellett). A protonpumpa adásra reagáló eozinofil özofagitisz eseteket proton-pumpa inhibitor responder altípusnak tartják. A fentieket ki szokták egészíteni jelentős szűkület kialakulása esetén nyelőcsőtágítással7.
Eozinofil gasztritisz (EG)
Az EGID gyomorra lokalizálódó formájának vezető tünete az epigastrialis fájdalom, hányinger, hányás, testsúlycsökkenés. Anémia és fehérjevesztő enteropátia is kialakulhat9-11. Általában a fundus és az antrum érintett (emiatt mindkét területről szükséges a mintavétel). Erythema, kifekélyesedés látható az endoszkópos vizsgálat során, a biopsziás mintában szöveti eozinofilia figyelhető meg. A kizárandó egyéb kóros állapotok (parazita fertőzések, hematológiai, nyirokcsomó rendellenességek, IBD) közül a Helicobacter pylori fertőzés és a Crohn betegség a leggyakoribb. Egy biopsziás leletekről szóló tanulmányban 60 EG és 135 kontrol páciens szövettani eredményét hasonlították össze. Az egészséges csoportban az eozinofil sejtek 1 mm2-re eső száma 1 páciens kivételével <55 volt, ugyanakkor az EG csoporban ez az érték 127 és 2108 közöttinek adódott10 (ez megfelel 30 – 500 eozinofil sejt/ nagyfelbontású látótérnek, mivel annak területe 0,237 mm2)9. Figyelembe véve, hogy a betegcsoportban mindössze 2 páciens értéke volt <190 (egyik 127, a másik 168 eozinofil sejt/mm2), így a ≥190/mm2 érték tekinthető az EG alsó határának. A Crohn betegek és Helicobacter pylori ferőzésben szenvedők eozinofil sejt denzitása csak minimálisan különbözött az egészséges populációétól: a maximum 203/mm2 (H. pylori) és 219/mm2 (Crohn beteg) volt10. Perifériás eozinofilia 23-86%-ban fordul elő, hiánya nem zárja ki a kórképet és mértéke nincs kapcsolatban a betegség aktivitásával9,10. Kezelése megegyezik az EGE részben leírtakéval9-11.
Eozinofil enteritisz (EE)
Az EGID vékonybélre lokalizálódó formája (EE) nagyon ritka állapot (prevalenciáját 1/100 000-nek tartják). Férfiakban nagyobb számban fordul elő, életkori gyakorisági csúcsát 30 és 40 éves kor közé teszik. A panaszok nem specifikusak, megjelenésüktől mintegy 2 év telik el a diagnózis megszületéséig12. Bevezető tünetek: hasi fájdalom, hányinger/hányás, hasmenés, ascites, de emellett sárgaság, gyomor-bélrendszeri vérzés is kialakulhat. Sebészi beavatkozást igénylő szövődmények (elzáródás, szűkület, peritonitis) is előfordulhatnak. A mucosa érintettsége esetén hasi fájdalom, hasmenés, vérzés, a muscularis réteg betegsége mellett elzáródásra jellemző tünetek a jellemzőek, a subserosalis infiltrációt az eozinofil sejtekben gazdag hasűri folyadék, a felfúvódás és hasi fájdalom karakterizálja. Az altípusok gyakorisága32: mucosalis: 57,5%; muscularis: 30%, subserosalis: 12,5%.
A proximalis vékonybélszakasz érintettsége esetén fehérjevesztő enteropátia (PLE) alakul ki hipoalbuminémiával, malabszorpcióval (zsírszékelés, nyomelem- és vitaminhiány), vashiányos anémiával. Perifériás eozinofiliát (>500 eozinofil sejt/ml) az esetek 70-80%-ában figyeltek meg, mely a subserosalis formánál éri el a legmagasabb szinteket. A betegek kb. felében magas a szérum IgE szint. A diagnózishoz felső gasztrointesztinális endoszkópos vizsgálat és ileokolonoszkópia továbbá biopszia szükséges, melyet ultrahang, CT, MR képalkotással egészítenek ki. A vékonybelek kontrasztanyagos röntgenvizsgálata során válik jól láthatóvá a falvastagodás, szűkület és tágulat valamint a terminális ileum fekélyesedéssel járó gyulladása. Mind ezek mellett ki kell zárni az előzőekben már említett kórképeket, mely hasonló tünetekkel (beleértve a szöveti eozinofiliát is) járhatnak. Kezelése hasonló, szteroidok, immunszuppresszív szerek, biológiai terápia (Mepolizumab – anti-IL5) adásából állnak. Spontán remisszió is előfordulhat12.
Eozinofil kolitisz (EC)
Az EC az EGID legritkább megjelenési formája14. Bimodális életkori eloszlású (újszülöttkor; fiatal felnőttkor), akut, véres vagy nyákos hasmenéssel járó kórkép13-17. Kolonoszkópia során egészséges szakaszok mellett foltos erythema, sérülékeny, fekélyes területek figyelhetők meg13,17. A biopsziás mintában eozinofil sejtes infiltráció (legalább két különböző helyről vett mintában >40 eozinofil sejt nagyfelbontású látóterenként16) észlelhető, mely lehet diffúz vagy fokális13, továbbá kripta abszcesszus, limfonoduláris hiperplázia is látható17. A vastagbél fal megvastagodhat, perforálhat14.
A diagnózishoz az említett tüneteken és szöveti eozinofilián kívül, a szöveti eozinofiliát okozó egyéb kórkép kizárása is hozzátartozik. Ezek közül a leggyakoribbak: parazitafertőzés: 5-10%, IBD. 10%; gyógyszer-indukálta állapotok: 3%; hipereozinofil szindróma: 1%16. Egy 172 colon eozinofiliával járó betegcsoport elemzésével foglalkozó tanulmányban a következő betegségmegoszlás arányt találták15:
| Diagnózis | % |
| IBD | 21,7 |
| Ismeretlen eredet | 19,7 |
| Diszmotilitás | 19,2 |
| EC | 18,7 |
| Fertőzés | 7,2 |
| Egyéb | 4,9 |
| Szervtranszplantáció utáni állapot | 2,8 |
| Ételérzékenység | 2,4 |
| Immunhiányos állapot | 2,0 |
| Autoimmun betegség | 0,8 |
| Hízósejt rendellenesség | 0,3 |
| Gyógyszer-asszociált kolitisz | 0,3 |
Az EC kezelése az előző entitásokkal megegyező13-17: étrendváltoztatás, szteroidok, immunmodulátorok, leukotrién receptor antagonista, hízósejt stabilizátor, biológiai kezelés (újabban eotaxin receptor elleni antitest, anti-CCR317).
Irodalom
- N Gonsalves: Eosinophilic gastrointestinal diseases 2021, UpToDate, https://www.uptodate.com/contents/eosinophilic-gastrointestinal-diseases?search=Eosinophylic%20Gastrointestinal%20Diseases&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1
- A A Rached, W El Haj: Eosinophilic gastroenteritis: Approach to diagnosis and management 2016, World Journal of Gastrointestinal Pharmacology and Therapeutics, 7(4):513-523, DOI: 10.4292/wjgpt.v7.i4.513
- T Sunkara, P Rawla et al: Eosinophilic gastroenteritis: diagnosis and clinical perspectives 2019, Clinical and Experimental Gastroenterology, 12:239-253, http://doi.org/10.2147/CEG.S173130
- M H Collins: Histopathologic Features of Eosinophilic Esophagitis and Eosinophilic Gastrointestinal Diseases 2014, Gastroenterology Clinincs of North America, 43(2):257-268; doi:10.1016/j.gtc.2014.02.007
- MyNgoc T Nguyen: Eosinophilic gastroenteritis 2019, emedicine/Medscape, https://emedicine.medscape.com/article/174100-print
- P A L Bonis, S K Gupta: Clinical manifestation and diagnosis of eosinophilic esophagitis 2021, UpToDate, https://www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-eosinophilic-esophagitis?search=Clinical%20manifestation%20and%20diagnosis%20of%20eosinophilic%20esophagitis&source=search_result&selectedTitle=1~102&usage_type=default&display_rank=1
- G T Furuta: Eosinophilic Esophagitis 2015, New England Journal of Medicine, 373(17):1640-1648, doi:10.1056/NEJMra1502863. (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4905697/ )
- N Tetavian: Eosinophilic Esophagitis 2020, emedicine/Medscape, https://emedicine.medscape.com/article/1610470-print
- H M Ko, R A Morotti, et al: Eosinophilic gastritis in children: Clinicopathological Correlation, Disease Course, and Response to Therapy 2014, American Journal of Gastroenterology, 109:1277-1285, doi: 10.1038/ajg.2014.166
- J M Connors: Eosinophilic Gastritis 2007, xPharm: The Comprehensive Pharmacology Reference, 1-6, doi:10.1016/b978-008055232-3.60718-4
- T Lwin, S D Melton, R M Genta: Eosinophilic gastritis_ histopathological characterization and quantification of the normal gastric eosinophil content 2011, Modern Pathology, 24:556-563, doi:10.1038/modpathol.2010.221
- G P de Chambrun, P Desreumaux, A Cortot: Eosinophilic Enteritis 2015, Digestive Diseases, 33:183-189, DOI: 10.1159/000369540
- A A Alfadda, M A Storr, E A Shaffer: Eosinophilic colitis: an update on pathophysiology and treatment 2011, British Medical Bulletin, 100:59-72, DOI:10.1093/bmb/ldr045
- A A Alfadda, M A Storr, E A Shaffer: Eosinophilic colitis: epidemiology, clinical features, and current management 2010, Therapeutic Advances in Gastroenterology, 4(5):301-309, DOI: 10.1177/1756283X10392443
- L A DiTomasso, C E Rosenberg et al: Prevalence of eosinophilic colitis and the diagnoses associated with colonic eosinophilia 2019, Journal of Allergy and Clinical Immunology, 143(5):1938-1930, https://doi.org/10.1016/j.jaci.2018.12.1002
- G Macaigne: Eosinophilic colitis in adults 2020, Clinics and Research in Hepatology and Gastroenterology, 44:630-637, https://doi.org/10.1016/j.clinre.2020.02.019
- G Impellizzeri, G Marasco et al: Eosinophilic colitis: A clinical review 2019, Digestive and Liver Disease, 61:763-773, https://doi.org/10.1016/j.dld.2019.04.011
- Xing Huang, Xiangqi Xiao et al: Halo sign and araneid limb sign in eosinophilic enteritis 2020, Lancet Gastroenterology and Hepatology, 5:594, https://doi.org/10.1016/S2468-1253(20)30115-1
- H Han, F Roan, S F Ziegler: The atopic marsh: current insight into skin barrier dysfunction and epithelial cell-dewrived cytokines 2017, Immunology Reviews, 278(1):116130; doi: 1111/imr.12546.
- M S Gold, A S Kemp: Atopic Disease in Childhood 2005, Medical Journal of Australia, 182(6):298-304, doi: 10.5694/j.1326-5377.2005.tb06707.x
- D Verschoor, S von Gunten: Allergy and Atopic Diseases: An Uptake and Experimental Evidence 2019, International Archives of Allergy and Immunology, 180:235-243, DOI: 10.1159/000504439
- Kuan-Wen Su, Sarita Patil et al: Food aversion and poor weight gain in food protein-indiced enterocolitis syndrome: A retrospective study 2020, Journal of Allergy and Clinical Immunology, 145:AB52, doi: 10.1016/j.jaci.2019.12.687
- J C Caubet, L S Ford et al: Clinical features and resolution of food protein–induced enterocolitis syndrome: 10-year experience 2014, Journal of Allergy and Clinical Immunology, 134(2):382-389, doi: 10.1016/j.jaci.2014.04.008
- C Delahaye, A Chauveau et al: Food protein-induced enterocolitis syndrome (FPIES) in 14 children 2017, Archives de Pédiatrie, 24(4):310-316, doi: 1016/j.arcped.2017.01.011
- A C Lozinsky, M B de Morais: Eosinophilic colitis in infants 2014, Jornal de Pediatria, 90(1):16-21, doi:1016/j.jped.2013.03.024
- A Ravelli, V Villanacci Dietary Protein-Induced Proctocolitis in Childhood 2008, American Journal of Gastroenterology, 103(10):2605-2612, doi: 1111/j.1572-0241.2008.02035.x
- L Labrosse, F Graham and J-C Caubet: Non-IgE-Mediated Gastrointestinal Food Allergies in Children: An Update 2020, Nutrients, 12:2086, doi:10.3390/nu12072086
- L Connors, A O’Keefe et al: Non-IgE-mediated food hypersensitivity 2018, Allergy, Asthma & Clinical Immunology, 14(Suppl. 2):56, https://doi.org/10.1186/s13223-018-0285-2
- A Nocerino: Protein Intolerance 2017, emedicine/Medscape, https://emedicine.medscape.com/article/931548-print
- K L McClain, G Goyal: Clinical manifestation, pathologic features, and diagnpsis of Langerhans cell histiocytosis 2022, UpToDate, https://www.uptodate.com/contents/clinical-manifestations-pathologic-features-and-diagnosis-of-langerhans-cell-histiocytosis?sectionName=Pathologic%20features&topicRef=2536&anchor=H3894908826&source=see_link#H3894908826
- A J Lucendo, B Serrano-Montalban et al: Efficacy of Dietary Treatment for Inducing Disease Remission in Eosinophilic Gastroenteritis 2015, J Pediatr Gastroenterol Nutr, 61(1):56-64, DOI: 1097/MPG.0000000000000766
- N J Talley, R G Shorter et al: Eosinophilic gastroenteritis: a clinicopathological study of patients with disease of the mucosa, muscle layer, and subserosal tissues 1990, Gut, 31(1):54-58, doi: 1136/gut.31.1.54
A J Katz, F J Twarog et al: Milk-sensitive and eosinophilic gastroenteropathy: similar clinical features with contrasting mechanisms and clinical courses 1984, J



