Gyulladásos bélbetegségek (IBD) kezelésének étrendi támogatása
szerző: Dr. Krkos Károly
A gyulladásos bélbetegségek (Inflammatory Bowel Disease – IBD) közé két kórkép tartozik: a colitis ulcerosa (UC) és a Crohn betegség (CD). Az IBD kialakulásának okai ma sem teljesen tisztázottak, de komplex genetikai, környezeti és immunológiai tényezők, valamint a bélben a mikroba összetétele abban jelentős szerepet játszik5. Annak ellenére, hogy a két állapot más patológiai és klinikai jellegzetességeket mutat, jelentős átfedés is megfigyelhető a kettő között. Az UC a vastagbeleket érinti, míg a CD a gyomor-bél rendszeren (a szájüregtől a végbélnyílásig) bárhol megjelenhet1-4. UC esetén az érintett vastagbél nyálkahártyájára korlátozódó folytonos gyulladása, míg Crohn betegség esetén az egész bélfalat átható (transmuralis), leggyakrabban az csípőbelet és a vastagbél kezdeti szakaszát érintő, nem folytonos, fibrózissal és hegesedéssel járó gyulladás jellemzi1,2,4,7.
Az IBD gyakran társul bélrendszeren kívüli megbetegedésekkel. Már a diagnózis felállításakor a betegek kb. 10 %-ánál megfigyelhető társuló betegség, mely életük során a páciensek egynegyedében megjelenik. Az érintett szervek: csont-izomrendszer (izületi gyulladások, oszteoporózis, oszteonekrózis), szem (ínhártya, szivárványhártya, kötőhártya gyulladása), máj (primer szklerotizáló kolangitisz – PSC, zsírmáj, autoimmun májbetegség), véralvadás (fokozott hajlam trombózis kialakulására), vérképzőrendszer (autoimmun hemolitikus anémia), tüdő (légúti gyulladás, parenchymás tüdőbetegség)2 .
Az IBD diagnosztizálásakor a következő állapotokat kell kizárni2:
• fertőzéses eredetű (baktériumok, paraziták, vírusok) colitisek,
• radiációs colitis (anamnézisben sugárkezelés),
• diverziós colitis (bélszakasz sebészi kizárása az előzményben),
• szoliter végbélfekély szindróma (szövettani képe alapján különíthető el),
• graft versus host betegség (csontvelő transzplantációt követően),
• diverticulum colitis – a diverticulum bemenet nem érintett, eloszlása eltérő (egy szegmentumra kiterjedő eltérés) a diverticulitistől,
• gyógyszerszedéssel összefüggő bélgyulladás (nem-szteroid gyulladás csökkentők, retinsav, checkpoint inhibitorok, mycophenolate),
• bizonyos immunhiányos állapotok (common variable immunodeficiency – CVID).
Az IBD diagnosztikájában képalkotó eljárások (hasi MR – MRE, hasi CT – CTE, UGI/SBFT (upper gastrointestinal series with small bowel follow-through), gasztroszkópia, kolonoszkópia, ultrahang vizsgálat kontrasztanyaggal (PEG3350) – SICUS (small intestine contrast ultrasonography) alapvető szerepet játszanak. A laboratóriumi vizsgálatok közül a széklet mikrobiológiai elemzése mellett a betegség aktív szakaszának kimutatásához a széklet calprotectin (esetleg lactoferrin), a vérsüllyedés és a szérum CRP mérése kiemelendő.
Az IBD az egész világon elterjedt, de elsősorban a nyugati világ lakosságát érinti, előfordulását tekintve az újonnan iparosodó országok, végül a fejlődő országok következnek. Epidemiológiai szempontból 4 stádium figyelhető meg6:
1. a betegség megjelenése (emergence)
2. az incidencia fokozódása (acceleration of incidence)
3. az összetett prevalencia (compounding prevalence) és
4. a prevalencia egyensúly (prevalence equilibrium)
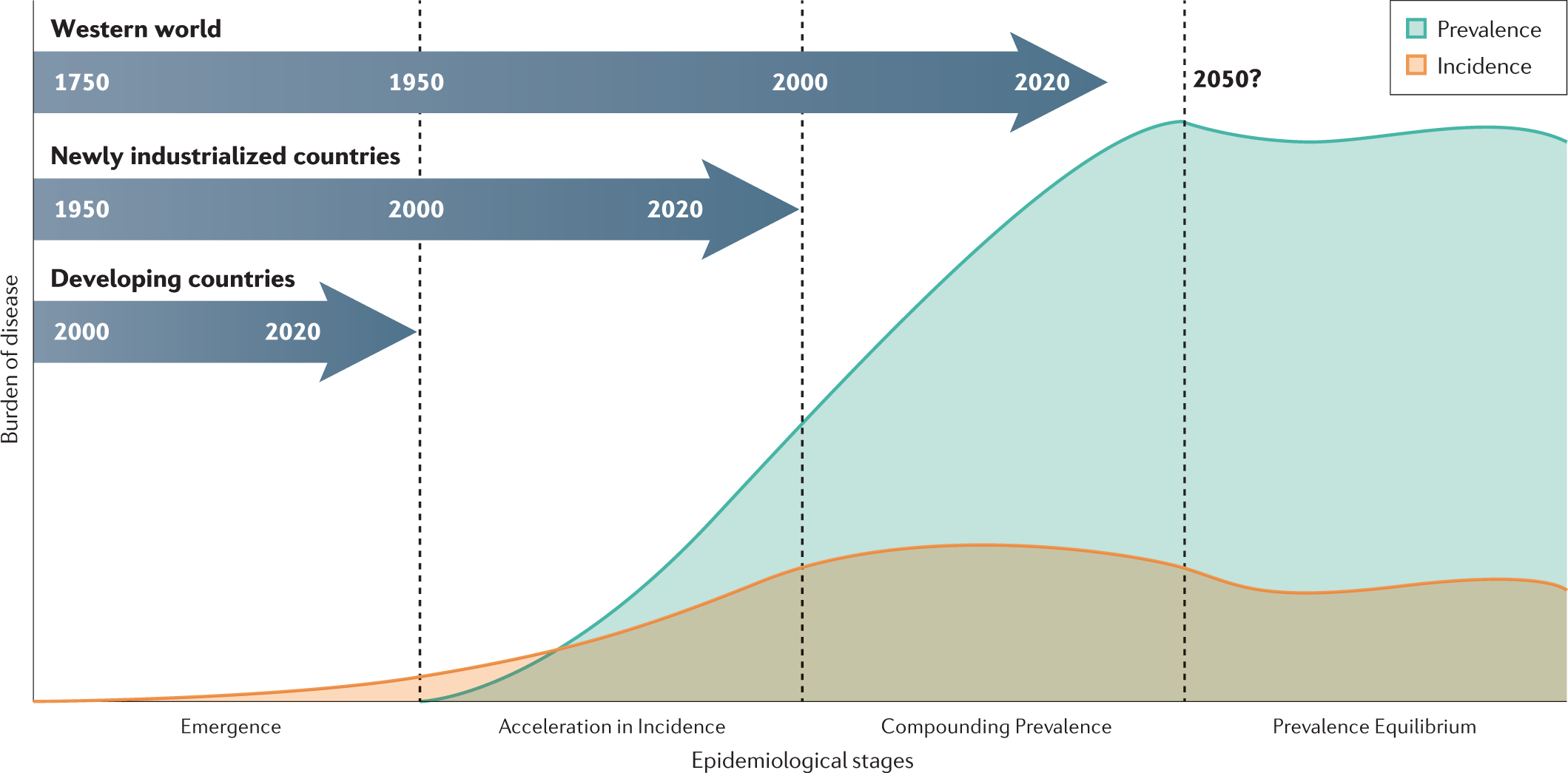
A nyugati társadalmak jelenleg a 3. (Compounding Prevalence) stádiumban vannak, feltehetőleg megkezdődik az átmenet a prevalencia egyensúly állapotába6.
A gyulladásos bélbetegségeket befolyásoló rizikó tényezők1,22:
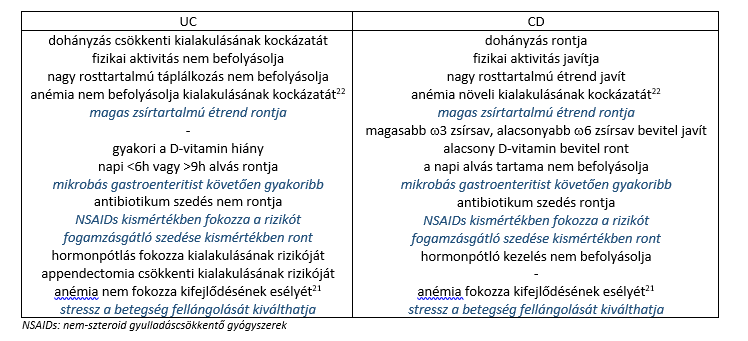
A colitis ulcerosa (UC) krónikus, javulásokkal (remisszió) és visszaesésekkel (relapszus) járó, a colon nyálkahártyáját érő gyulladás, mely folytonos jellegű1,2. A betegség kiterjedése alapján létezik csak a végbélre korlátozódó forma (ulcerativ proctitis), a végbelet és szigmabelet érintő betegség (ulcerativ proctosigmoiditis), a flexura lienalisig terjedő forma (bal oldali colitis) és az azon is túli gyulladást okozó kiterjedt colitis1,2.
Fő tünetek a hasmenés, mely lehet véres, gyakori bélmozgások, hasi fájdalom, hirtelen székelési inger, görcsök, inkontinencia. Distalis betegség esetén székrekedés is előfordulhat, vér- és nyákürüléssel. A tünetek fokozatosan fejlődnek ki. Láz, kimerültség, súlyvesztés is társulhat az állapothoz. Vérszegénység miatt nehézlégzés és erős szívdobogás érzés is előfordulhat2,4.
A Crohn betegség tünetei hasonlóak lehetnek, de jelentősebb vérzés nem fordul elő, gyakoriak a végbélnyílás megbetegedései (fissurák, tályogok, fistulák), a csípőbél érintettség, az endoszkópos kép jelentősen eltér (foltos, nem folytonos érintettség, granulomák, szűkületek)1,2,4,7.
Kezelésüket gasztroenterológus szakorvos állítja be. Használt gyógyszerek: mezalazin (5-ASA), szteroidok (budezonid), immunmodulátorok (azatioprin, 6-merkaptopurin, metotrexát), biológiai terápiák (TNF-, IL12/23-, integrin 47-antitestek)7.
Az IBD nem aktív (fellángolás-mentes) szakaszaiban funkcionális bélbetegségre (irritábilis bél szindrómára – IBS-re) emlékeztető tünetek figyelhetők meg. A betegség remissziós fázisát a figyelmeztető jelek (véres széklet, láz, nem-várt súlyvesztés, éjszakai bélmozgások, nagyfokú hasmenés – napi 6-nál többszöri vizes székürítés, felfúvódás, hasi daganat) hiánya valamint a CRP és a calprotectin normál szintje támasztja alá3. Ilyenkor a következő állapotokat szükséges kizárni3,8,9:
• cöliákia (malabszorpció jelei – vashiányos anémia)
• fertőzéses hasmenés (Giardia, Clostridioides difficile)
• tejcukor intolerancia
• SIBO (small intestinal bacterial overgrowth) – bizonytalan a diagnosztikája jelenleg
• epesav diarrhoea (ileum betegsége vagy reszekciója miatt a primer epesavak nem szívódnak vissza és a vastagbélbe jutva hasmenést váltanak ki)
• diszbiózis indukálta szekunder epesavhiány miatti bélgyulladás8 (a szekunder epesavak – litokólsav és deoxikólsav – gyulladás csökkentő hatásúak, kialakulásukhoz szükséges 7-hidroxilációt csak néhány Ruminococcaceae családba tartozó baktérium képes elvégezni)
• a hasnyálmirigy elégtelen exokrin működése (krónikus hasmenés, hasi fájdalommal) – alacsony széklet elasztáz (200g/g) szint
• mikroszkópos colitis (nőkben gyakoribb ritka betegség, melyre a hasmenés jellemző, melyet néha fájdalom kísér, az IBS-D-re hasonlít, normális vagy közel normális kolonoszkópos képpel, a vastagbél több pontjából vett mintából végzett szövettani vizsgálat bizonyítja)
• tüneteket okozó nem-komplikált diverticulum betegség (symptomatic uncomplicated diverticular disease – SUDD – 24 óránál tovább tartó, IBS-nél súlyosabb tünetek, melyek a has bal alsó kvadránsára lokalizálódnak)
Funkcionális bélpanaszok esetén a tünetek enyhítésére elsődlegesen az IBS ill. funkcionális diszpepszia (felső gyomor-bélrendszeri tünetek) kezelésénél javasoltak az irányadók: étrend és életmód módosítás3.
Élelmiszeripari termékek fogyasztásának ellenőrzésére egy kérdőívet (processed food frequency questionnaire, PFQ) validáltak, hogy az ilyen termékek fogyasztása és a betegség tüneteinek kapcsolatát kiderítsék19.
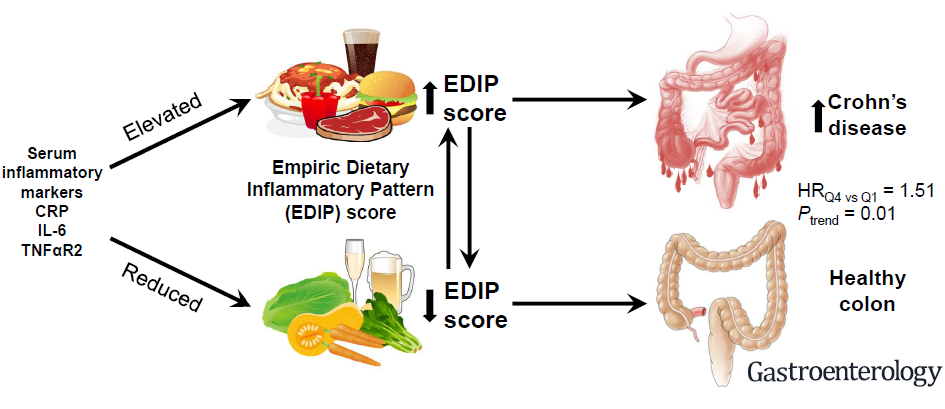
Egy 8 éven át tartó tanulmányban megvizsgálták a gyulladáskeltő hatású ételek szerepét az IBD-ben18. Az ételcsoportokat proinflammatorikus paraméterek (IL-6, CRP, TNFR2, adiponectin) szérumszintjének emelkedését és az ételfogyasztást RRR (redukált rank regresszió) módszerrel vizsgálták25, mely alapján egy-egy ételcsoportot EDIP (empirikus diétás gyulladásos mintázat, Empiric Dietary inflammatory Pattern) score-ral jellemeztek. (Magas pontszám gyulladásos, míg alacsony pontszám nem gyulladásos étrendet jelentett.) Megállapították, hogy magas gyulladásos pontszámú étrend fokozta a Crohn betegség rizikóját, ugyanakkor az ulceratív colitisre nem volt hatással.
A mediterrán diéta jótékony hatású Crohn betegségben. A nyugati diétát tartók között szignifikánsan nagyobb arányban fordult elő relapszus, míg a mediterrán diétát fogyasztók esetén a páciensek zöme remisszióban volt, alacsonyabb volt CRP és IL-6 szintjük, magasabb az IL-10 koncentrációjuk15. Egy másik vizsgálatban egészséges és remisszióban lévő, IBD-vel diagnosztizált gyermekeken vizsgálták a mediterrán diéta hatását. Az IBD csoportban szignifikáns összefüggést találtak a mediterrán diéta be nem tartása és a széklet calprotectin szint között16.
Remisszióban lévő gyulladásos bélbetegségben szenvedőkön vizsgálták az alacsony FODMAP (fermentábilis oligo-, di-monoszacharidok és poliolok) hatását. Megállapították, hogy ugyan az irritábilis bélszindrómát jellemző pontok nem változtak jelentősen, de az életminőség szignifikánsan javult. A diétázó csoportban ugyan csökkent a Bifidobacterium adolescentis, a B. longum és a Faecalibacterium prausnitzii aránya, de a microbiota diverzitás megmaradt17.
A gyermekkori Crohn betegség kezelésében elsődleges szerepet játszik az exkluzív enterálás táplálás (EEN), viszont a teljesen folyadék alapú étrendet a gyermekek jelentős része nem tartja be. Ilyenkor egy speciális étrend, a Crohn betegek exklúziós diétája (CDED) részleges enterális táplálással (PEN) kombinálva jelentheti a megoldást, mivel a páciensek több, mint 95%-a tolerál. A vizsgálat során EEN, CDED+PEN és normál étrendet fogyasztó Crohn beteg gyermekek klinikai tüneteit (PCDAI: gyermekgyógyászati Crohn betegség aktivitási index) és gyulladásos markereit (szérum CRP, széklet calprotectin) és microbiomjuk változását értékelték. A CDED étrendet fokozatosan vezették be az EEn_t követően (PEN-nel kiegészítve). A diéta során a megfelelő rostbevitel mellett alacsony zsírbevitelt (elsősorban állati és tejtermék zsír mellőzése), gabonaféléktől, vörös húsoktól, élelmiszeripari termékektől, élesztőtől, taurinban gazdag fehérjéktől, emulzifikáló szerektől, mesterséges édesítőktől, hínároktól és szulfitoktól mentes étrendet írtak elő. Az EEN és a CDED+PEN lehetővé teszi, hogy szteroidmentesség legyen elérhető hosszú távon (összehasonlítva a diétás előírások nélküli csoporttal). A CDED+PEN viszont a páciensek nagyobb aránya által tolerált étrendi beavatkozás10. A CDED+PEN étrend jótékony hatását bizonyították gyógyszeres kezelésre (beleértve a modern biológiai szereket is) nemreagáló felnőttek és gyermekek esetén is22,23.
A remisszióban lévő, IBS-szerű tünetektől szenvedő páciensek esetén az eliminációs étrend jelentősen enyhítheti panaszaikat. Gyulladásos bélbetegek (mind Crohn betegek, mind ulceratív colitises páciensek) szérumában szignifikánsan több étel ellen jelenik meg IgG antitest, mint a nem-IBD populációban11. Egy másik tanulmányban kimutatták, hogy CD betegek körében magasabb szintű IgG intolerancia volt megfigyelhető, melyet az infliximab kezelés csökkentett, a betegek állapota jelentősen javult. Ennek alapján feltételezik, hogy az IgG szitn csökkenés a bélnyárkahártya gyógyulását tükrözi14.
Egy Crohn betegeket értékelő kettősvak, keresztezett tanulmányban az IgG antitest pozitivitáson alapuló eliminációs étrend hatását vizsgálták. Megállapították, hogy abban a csoport, amelyik az eliminációs étrendet kapta, szignifikánsan javultak a tünetek (a székletürítés gyakorisága, a hasi fájdalom csökkent, az életminőség javult). Ez a hatás akkor is kimutatható volt, mikor a nem-eliminációs étrendet az IgG pozitivitás alapú diéta váltotta fel és állapotromlás volt megfigyelhető, amikor a diétát a nem-eliminációs étrend követte. A leggyakrabban pozitív ételek: sajtok, élesztő, agave szirup, bambuszrügy, gabonafélék voltak12.
Az eliminációs étrend jótékony hatását24 colitis ulcerosás betegek körében is vizsgálták. A tanulmányban résztvevők felének normál, egészséges étrendet írtak elő, míg a tanulmányba bevontak másik fele IgG-intolerancia alapján beállított eliminációs diétában részesült. A speciális étrendben részesült csoportban szignifikánsan alacsonyabb lett a betegség aktivitását jellemző Mayo score, az extraintestinalis érintettség mértéke jelentősebben csökkent, a BMI és az albuminszint kifejezettebben javult, mint a normál étrendet fogyasztó csoportban13.
Jól ismert, hogy a gyulladásos bélbetegségben szenvedők mikrobiomja jelentősen eltér az egészségesekétől. UC betegek esetén a kombinált antibiotikum (amoxicillin, foszfomicin, metronidazol) kezelést követő széklet mikrobiom transzplantáció (FMT) hatását hasonlították össze a csak kombinált antibiotikus kezelést kapók csoportjával. Bebizonyosodott, hogy a hosszútávú jótékony hatása az FMT-t kapó csoport esetében szignifikánsan jobb volt. Azt is kimutatták, hogy azok esetében, akiknél a donor mikrobiom összetétele (főként a Bacteroides törzs) a betegéhez hasonló volt, a beavatkozás nagyobb sikerrel járt20.
IRODALOM
1. M A Peppercorn, A S Cheifetz: Definitions, epidemiology, and risk factors for inflammatory bowel disease in adults, UpToDate 2020, https://www.uptodate.com/contents/definitions-epidemiology-and-risk-factors-for-inflammatory-bowel-disease-in-adults?search=inflammatory%20bowel%20disease&source=search_result&selectedTitle=3~150&usage_type=default&display_rank=3
2. M A Peppercorn, S V Kane: Clinical manifestation, diagnosis, and prognosis of ulcerative colitis in adults, UpToDate 2020, https://www.uptodate.com/contents/clinical-presentation-and-diagnosis-of-inflammatory-bowel-disease-in-children?search=inflammatory%20bowel%20disease&source=search_result&selectedTitle=2~150&usage_type=default&display_rank=2
3. P Gibson: Approach to functional gastrointestinal symptoms in adults with inflammatory bowel disease, UpToDate 2020, https://www.uptodate.com/contents/approach-to-functional-gastrointestinal-symptoms-in-adults-with-inflammatory-bowel-disease?search=inflammatory%20bowel%20disease&source=search_result&selectedTitle=4~150&usage_type=default&display_rank=4
4. L M Higuchi, A Bousvaros: Clinical presentation and diagnosis of inflammatory bowel disease in children, UpToDate 2020, https://www.uptodate.com/contents/clinical-presentation-and-diagnosis-of-inflammatory-bowel-disease-in-children?search=inflammatory%20bowel%20disease&source=search_result&selectedTitle=2~150&usage_type=default&display_rank=2
5. J T Chang: Pathophysiology of Inflammatory Bowel Diseases, NEJM 2020, 383:2652-2664, https://doi.org/10.1056/NEJMra2002697
6. G G Kaplan and J W Windsor: The four epidemiological stages in the global evolution of inflammatory bowel disease, Nature Reviews Gastroenterology & Hepatology 2021 18:56–66, https://doi.org/10.1038/s41575-020-00360-x
7. K Cushing, P D R Higgins: Management of Crohn Disease, JAMA 2021, 325(1):69-80, https://doi.org/10.1001/jama.2020.18936
8. S R Sinha, Y Haileselassie et al.: Dysbiosis-Induced Secondary Bile Acid Deficiency Promotes Intestinal Inflammation, Cell Host&Microbe 2020, 4:659-670.e5, https://doi.org/10.1016/j.chom.2020.01.021
9. I Aziz, M Simrén: The overlap between irritable bowel syndrome and organic gastrointestinal diseases, Lancet Online First November 12 2020, https://doi.org/10.1016/S2468-1253(20)30212-0
10. Levine, N Wine et al.: Crohn’s Disease Exclusion Diet Plus Partial Enteral Nutrition Induces Sustained Remission in a Randomized Controlled Trial, Gastroenterol 2019, 157(2):440-450.e8, https://doi.org/10.1053/j.gastro.2019.04.021
11. C Cai, J Shen et al.: Serological Investigation of Food Specific Immunoglobulin G Antibodies in Patients with Inflammatory Bowel Diseases, PLOS ONE 2014, 9(11): e112154, https://doi.org/10.1371/journal.pone.0112154
12. S Bentz, M Hausmann et al.: Clinical relevance of IgG antibodies against food antigens in Crohn’s disease: a double-blind cross-over diet intervention study, Digestion 2010, 81:252-264, https://doi.org/10.1159/000264649
13. L Jian, H Anqi et al.: Food Exclusion Based on IgG Antibodies Alleviates Symptoms in Ulcerative Colitis: A Prospective Study, Inflamm Bowel Dis 2018, 24(9):1918-1925, https://doi.org/10.1093/ibd/izy110
14. N Xiao, F Liu et al.: Food-specific IgGs Are Highly Increased in the Sera of Patients with Inflammatory Bowel Disease and Are Clinically Relevant to the Pathogenesis, Intern Med 2018, 57:2787-2798, https://doi.org/10.2169/internalmedicine.9377-17
15. E Papada, C Amerikanou et al.: Adherence to Mediterranean diet in Crohn’s disease, Eur J Nutr 2020, 59(3):1115-1121, https://doi.org/10.1007/s00394-019-01972-z
16. C Strisciuglio, S Cenni et al.: Effectiveness of Mediterranean Diet’s Adherence in children with Inflammatory Bowel Diseases, Nutrients 2020, 12(10):3206, https://doi.org/10.3390/nu12103206
17. S R Cox, J O Lindsay et al.: Effects of Low FODMAP Diet on Symptoms, Fecal Microbiome, and Markers of Inflammation in Patients With Quiescent Inflammatory Bowel Disease in a Randomized Trial, Gastroenterol 2020, 158(1):176-188.e7, https://doi.org/10.1053/j.gastro.2019.09.024
18. Chun-Han Lo, Paul Lochhead et al.: Dietary Inflammatory Potential and Risk of Crohn’s Disease and Ulcerative Colitis, Gastroenterol 2020, 159(3):873-883.e1, https://doi.org/10.1053/j.gastro.2020.05.011
19. C Sarbagili-Shabat, S Zelber-Sagi et al.: Development and validation of processed foods questionnaire (PFQ) in adult inflammatory bowel diseases patients, Eur J Clin Nutrition 2020, 74:1653-1660, https://doi.org/10.1038/s41430-020-0632-5
20. K Okahara, D Ishikawa: Matching between Donors and Ulcerative Colitis Patients Is Important for Long-Term Maintenance after Fecal Microbiota Transplantation, J. Clin. Med. 2020, 9(6):1650, https://doi.org/10.3390/jcm9061650
21. E A Kang, J Chun et al.: Anemia is associated with the risk of Crohn’s disease, not ulcerative colitis: A nationwide population-based cohort study, PLOS ONE 2020, https://doi.org/10.1371/journal.pone.0238244
22. Rotem Sigall Boneh, Chen Sarbagili Shabat et al.: Dietary Therapy With the Crohn’s Disease Exclusion Diet is a Successful Strategy for Induction of Remission 2017, J Crohns Colitis, 11(10):1205-1212, https://doi.org/10.1093/ecco-jcc/jjx071
23. A M Riordan, J O Hunter et al.: Treatment of active Crohn’s disease by exclusion diet: East Anglian Multicentre Controlled Trial. Lancet 1993, 342:1131-1134, https://doi.org/10.1016/0140-6736(93)92121-9
24. M H DeLegge: Nutritional and dietary management for adults with inflammatory bowel disease UpToDate, https://www.uptodate.com/contents/nutrition-and-dietary-management-for-adults-with-inflammatory-bowel-disease?search=Nutritional%20and%20dietary%20management%20for%20adults%20with%20inflammatory%20bowel%20disease%20&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1



