Táplálkozási pszichiátria
Roger A. H Adan et al.: Nutritional psychiatry: Towards improving mental health by what to eat
European Neuropsychopharmacology, 2019, 29(12):1321-1332; https://doi.org/10.1016/j.euroneuro.2019.10.011
fordította: Dr. Krkos Károly
-
- Korlátozott tudományos bizonyítékok a táplálkozás mentális egészségre gyakorolt hatására
Nagyon nehéz igazolni, hogy egy specifikus diéta vagy egy adott étrendi komponens hozzájárul a mentális egészséghez. A hangulatzavarok, stressz-indukálta kognitív sebezhetőség és a pszichiátriai betegségek száma folytonosan emelkedik Európában és a világ többi részén.
Az agy összetétele, szerkezete és működése függ a megfelelő táplálék (lipidek, aminosavak, vitaminok, ásványi anyagok) hozzáférhetőségétől ( 1.) Emiatt a táplálkozás és a étel minősége hatással van az agy működésére, ami a diétát egy módosítható változóvá teszi a mentális egészség, a hangulat és a kognitív képességek befolyásolására.( 2. ) Ráadásul az étel összetétele közvelten hatással van bélben termelődő hormonokra, neuropeptidekre, neurtransmitterekre és a bél mikrobiotára. ( 3. ) A keresztmetszeti populációs tanulmányok információt szolgáltattak arról, hogy a táplálkozás, a diéta kapcsolatban áll a mentális egészséggel és betegségekkel, de nem mutatták ki az ok-okozati összefüggéseket, a jótékony, gyógyító hatást. A megfelelően hosszú ideig tartó és kellően specifikus kontrollált diétás tanulmányok néhány kivételtől eltekintve hiányoznak. Sokszor hiányzik a megfelelő esetszám, a vizsgált minta heterogén, nem alkalmaznak biomarkereket a vizsgált populáción belüli osztályozásra, nincs megfelelő vak csoport, nincs randomizáció a csoportok és vizsgálók kijelölésére. Kis esetszám miatt nehéz a hatást kimutatni. A betegség miatt kialakuló speciális táplálék igény, speciális táplálékhiány (vagy többlet) hozzájárulhat a betegség progressziójához vagy súlyosságához vagy kiváltja a betegséget. Egy új tudomány, a „táplálkozási pszichiátria ( 4. ) reményt ad a mentális állapot, a pszichiátriai betegségek és az étrendi beavatkozások hatásának kimutatására.
2. Meta-analízisekből származó bizonyíték, hogy az étel hatással van a mentális egészségre
Számos tanulmány számol be arról, hogy a mentális egészség és a táplálkozás között szoros kapcsolat van. ( 5. ). Friss gyümölcsökben és zöldségekben gazdag étrend összefüggésben áll a mentális egészséggel. ( 6.)
Több szisztémás beszámoló és meta-analízis jelent meg a táplálkozás és a mentális egészség közti összegfüggések tanulmányozásáról. Például 4 kohort és 9 keresztmetszeti tanulmány értékelése kimutatta, hogy csökken a depresszió előfordulásának valószínűsége magas gyümölcs, zöldség, hal és teljes kiörlésű gabonát tartalmazó étrend esetén ( 7. ). Egy másik meta-analízis 8 kohort tanulmányt és egy esettanulmányt elemez, melyben a mediterrán diéta depressziót csökkentő hatását igazolja ( 8. ). Egy legújabban megjelent, 20 longitudinális és 21 keresztmetszeti tanulmányt összefogó szisztémás beszámolóban a mediterrán diéta depresszió ellen védő hatásának igazolása olvasható ( 9. ). Továbbá egy 16 randomizált kontrollált vizsgálatot felsorakoztató meta-analízis mutatja, hogy az étrendi beavatkozás depresszió incidenciát csökkentő hatása ígéretes ( 10. ). Mindezekkel szemben egy kohort tanulmányokat értékelő meta-analízis szerint nincs szignifikáns összefüggés a mediterrán diéta és a depresszió rizikó között ( 11. ), ugyanakkor, amikor a keresztmetszeti tanulmányokat analizálták, fordított összefüggést találtak a betartott mediterrán diéta és a depresszió között. Összeségében ezek a tanulmányok igazolják, hogy további vizsgálatokat érdemes végezni a specifikus étrend mentális egészségre gyakorolt hatásáról.
3. Vitaminhiány és betegség-specifikus étrend hatása a mentális egészségre
Az étrendi beavatkozások kiemelkedő példája a ketogén diéta gyermekkori epilepsziára gyakorolt hatása ( 12. ). A mechanizmus ismeretlen, de az éhezési periódusban, mikor az agy energiaellátását a ketontestek szolgáltatják, az epilepsziás rohamok csökkenéséhez valószínűleg a megváltozott energiaellátás járul hozzá ( 13. ). Egy további példa a fenilketonuria, ahol az eliminációs diéta segít a kognitív hanyatlás megelőzésében ( 14. ). Tanulmányok bizonyították, hogy különböző tápanyagok,, elsősorban vitaminok hiánya a kognitív működés károsodásához vezet. ( 15. ). A legerősebb kapcsolat a B12-vitaminnal (hiánya fáradtságot, letargiát, depressziót memória problémákat okoz, és kapcsolatba hozható a mániával és a pszichózissal -minnal és a folsavval figyelhető meg – ( 16. ), a tiaminnal (B1-vitamin; hiánya a beriberit okozza, fő központi idegrendszeri megnyilvánulása a fásultság és a Wernicke-féle encephalopathia), a folsavval (B9-vitamin; hiánya kihat az idegrendszer méhen belüli és csecsemőkori fejlődésére; a folsav hiány fokozza a depresszió kialakulásának rizikóját a felnőttkorban – ( 17. ) , és a niacinnal (B3– vitamin; hiánya a demenciával társuló pellagrát okozza – ( 18.). Ezeken a hiányállapotokon túl nem tisztázott az enyhe „szubklinikus” vagy több tényező enyhe hiánya hogyan befolyásolja a mentális működést. Például a D-vitamin hatását számos tanulmányban kutatták – ellentmondó eredményeket kaptak. Közösségben élő 65 éves vagy annál idősebbeknél a magasabb szérum D-vitamin koncentráció jobb munkamemóriával, figyelem összpontosítással járt ( 19. ). A gyermekkort, serdülőkort és felnőttkort vizsgáló randomizált, kontrollált tanulmányok (RCT-k) bizonyították – bár nem egyöntetűen – a D-vitamin pótlás hatását a depresszióra ( 20. ) és a figyelemhiány-hiperaktivitás rendellenességekre (ADHD-ra – ( 21. ) ). Az egészséges csontok értékelése során származtatott határértékek alapján a népesség jelentős hányada D-vitamin hiányos, s ez aláhúzza annak szükségességét, hogy meggyőző bizonyíték szülessen a D-vitamin pótlás neuropszichiátriai betegségekre gyakorol hatására. Az egészséges étrend, mely gazdag polifenolokban, többszörösen telítetlen zsírsavakban és egyéb fontos anyagokban, mint a vitaminok, kedvező hatással van a mentális egészségre, beleértve a kognitív képességeket, hangulatot, stressz-reaktivitás és az idegrendszeri gyulladásos folyamatokra való hajlamot ( 22. ), főként olyan állapotokban, mint májbetegségek ( 23. ) és az időskor ( 24. ).
4. ADHD és ASD diéták
Számos étrendi beavatkozást tanulmányoztak az ADHD páciens csoportban. Egy 20 tanulmányt átölelő, 794 résztvevő adatait értékelő meta-analízis szerint az ételadalékok elhagyásának hatásnagysága kicsi, 0,18 lett, ami tovább csökkent 0,12-re, mikor a publikációs torzítás lehetőségét is figyelembe vették ( 25. ), bár több precíz eliminációs diéta hatásosnak bizonyult számos randomizált klinikai tanulmány szerint. Hat kontrollált vizsgálat két független meta-analízise alapján a hatásnagyság 0,29 és 0,51 közöttinek adódott ( 26. ) és arra a következtetésre jutottak, hogy az ADHD gyermekek harmada reagált a beavatkozásra (>40% tünetcsökkenés). Szabad zsírsavak adása szintén kicsi, de hitelt érdemlő ADHD-tünet csökkenéssel járt, a meta-analízisek szerint a hatáserősség 0,18 és 0,31 közöttinek adódott ( 27. ). Mikro-tápanyagokkal (vitaminok, ásványi anyagok) kiegészítve az étrendet csökkent agresszió és jobb érzelem-szabályozás volt megfigyelhető ADHD gyermekeknél ( 28. ) Egy új meta-analízis eredménye arra utal, hogy a magas finomított cukrokat és telített zsírokat tartalmazó étrend az ADHD és a hiperaktivitás rizikóját növeli, ugyanakkor a sok gyümölcsöt és zöldséget alkalmazó diéta védő hatású ( 29. ). Mindemellett azt hangsúlyozzák, hogy az irodalomban fellehető tanulmányok alacsony száma a tanulmányok tervezésének hiányosságai gyengítik a jelenlegi bizonyítékok súlyát és további longitudinális tanulmányok készítésére lenne szükség. Autizmus spektrum rendellenességek esetén végzett táplálkozási beavatkozások eredményei (a D-vitamin pótlástól a kazein- és glutén-mentes étrendig ) szintén nagyon eltérőek, precíz meta-analízis nem történt. Így autizmus esetén különösen szükség lenne jobb kontrollált tanulmányokra, a sokféle mechanizmus magyarázhatja a hatékonyságot ( 30. ).
5. A mentális egészségben szerepet játszó diétákról
Összességében kevés azoknak a randomizált kontrollált vizsgálatoknak (RCT-k) száma, melyek az étrendi változtatások mentális egészségre gyakorolt hatását vizsgálják. Az első ilyen vizsgálatok egyike a 12-heten át tartó mediterrán diéta hatását tanulmányozta. Depressziós páciensek hangulata szignifikánsan javult és csökkent szorongási szintjük ( 31. ). Több újabb tanulmány is igazolta a mediterrán típusú diéta jótékony hatását depresszióban, név szerint a HELFIMED ( 32. ) vizsgálat. Ezzel szemben egy multi-nutriens kiegészítést alkalmazó tanulmány (MooDFOOD RCT) szerint a depressziós epizódok száma nem csökkentdepresszív tünetekkel küzdő túlsúlyos vagy elhízott felnőtteken ( 33. ). Szükség lenne újabb, nagyobb, részletesebb randomizált, kontrollált tanulmányokra, melyek az étrendi változtatások mentális rendellenességekre gyakorolt hatását elemzik. Az eddigi tanulmányok rávilágítanak, hogy speciális diétás beavatkozások valószínű hatással vannak az agyműködésre és a mentális egészségre. További fontos lépés lenne a sejtszintű és metabolikus folyamatok feltérképezése az étrendi beavatkozások agyra gyakorolt hatásának megértéséhez. Ugyancsak szükséges lenne kideríteni, hogy egy adott diéta alkalmazásakor mely komponensek hatnak kedvezően a mentális egészségre ( 33. ).
6. Diéta, mentális egészség és kognitív funkciók az élet folyamán
A fejlődés alakulása az élet korai szakaszában meghatározza a későbbi fejlődést és hatással lehet arra, hogy az egyén milyen betegségekre válik érzékennyé. Emiatt a táplálkozás korai fejlődésre gyakorolt hatását is vizsgálni szükséges. Lehetséges, hogy az étrendi beavatkozás az agy korai fejlődésére (a megfogantatástól két éves korig) gyakorolt hatásának nagyobb jelentősége van a későbbi diétás beavatkozások okozta változásoknál. A tudomány előrehaladásának annak megértésében is segítenie kell, hogy a táplálék milyen hatással van az agyműködés szempontjából fontos (metabolikus, endokrin, immun és egyéb) jelképző folyamatokra, beleértve a bél mikrobiota felől érkezőket is ( 34. ).
Az újszülött emberi agy tömege a zsírmentes testtömeg 13%-át teszi ki és további növekedése és fejlődése nagyban függ a táplálkozástól ( 35. ) A mai napig a táplálkozási pszichiátria egyik fő kérdése az élet korai szakaszában történt nem megfelelő táplálás által kiváltott kognitív károsodás ( 36. ). Az élet korai szakaszában történő táplálkozás rágcsálókban lés az emberben kihat a felnőttkori kognitív működésre ( 37. ) Ráadásul azoknál, akik neurológiai károsodásra hajlamosabbak (koraszülöttek, kis súllyal születettek) közvetlen kapcsolat áll fenn a tápláltsági állapotuk és a neurológiai károsodás között ( 38. ).
Bár minden tápanyag fontos az agy fejlődéséhez, a fehérjék, a vas, a kolin, a folsav, a jód, az A-, D-, B6, B12-vitamin és a hosszúláncú, többszörösen telített zsírsavak a kulcsfontosságúak ( 39. ). Kísérleti adatokkal bizonyították, hogy az agykéreg sejtstruktúrája irreverzibilisen károsodik , amennyiben a magzati életben nem volt megfelelő a jódellátottság – ez abnormális idegsejt migrációt és kognitív károsodást okoz. Vashiányos vérszegénység a csecsemőkor folyamán agyi kapcsolatok megváltozását eredményezi ( 40. ) bár ennek az ellenkezőjéről is beszámoltak ( 41. ). Enyhébb diétás változások is hatással lehetnek a korai agyfejlődésre ( 42. ). Lipidek, pontosabban az w3 DHA (dokozahexaénsav) és az w6 ARA (arachidonsav) jelen van az anyatejben, de szintjét az anya táplálkozása befolyásolja ( 43. ) Egereken végzett tanulmányok azt mutatták, hogy az w3 zsírsavakban gazdag vagy w6 zsírsavakban szegény étrend pozitív hatással van az w3 zsírsavak idegsejt membránba történő beépülésére ( 44. ). Egy új, pszichológiai stressznek alávetett patkányokon végzett tanulmány kimutatta, hogy a serdülő agyban a kognitív képességek és a plaszticitási markerek javulnak, ha az étrend gazdag eikozapentaénsavban, dokozahexaénsavban, dokozapentaénsavban és A-vitaminban ( 45. ).
Anyai szeparációs stressz modellt alkalmazva patkányokon, a stressz hosszú távú hatása csökkenthető volt, ha a táplálék globuláris tejzsír membránt (MFGM-t) és polidextróz/galakto-oligoszacharid prebiotikumot tartalmazott.
( 46. ).
Ezek az eredmények aláhúzzák a kiegyensúlyozott étrend fontosságát az agy korai fejlődésében, a későbbi pszichiátriai betegségre való hajlamban, mely részben magyarázhatja a kezelésre adott eltérő válaszokat is.
7. Diéta, mentális egészség és kognitív funkciók a felnőttkorban és idős korban
A felnőttkorban alkalmazott jobb minőségű diéta csökkenti a kognitív hanyatlás rizikóját ( 47. ). Időskorban antioxidáns polifenolok fogyasztása javítja a kognitív képességeket ( 48.). Egy másik tanulmányban az olívaolajt és magokat tartalmazó mediterrán diéta kognitív működést javító hatását mutatták ki időseken ( 49. ). A diétás beavatkozásoknak ígéretes szerepe van a kognitív hanyatlás elleni küzdelemben, főként idős korban, fokozott stressz és szorongás esetén. Mivel a modern életben a stressz mindennapos és az idős populáció növekszik, a táplálkozás mentális egészségre gyakorolt hatásának további vizsgálata nagyon fontos lenne ( 50. ).
Ezekkel szemben a kiegyensúlyozatlan étrend a kardio-metabolikus betegségek és a kognitív hanyatlás kockázatát. Nyilvánvalóvá vált, hogy a gyenge minőségű diéta károsítja a mentális egészséget, ami az életkor előrehaladtával egyre kifejezettebbé válik ( 51. ). A táplálkozás és főként a helytelen táplálkozás és elhízás összefügg a hangulatszabályozással és stressz érzékenységgel, ami az étrend, a metabolizmus és a mentális jóllét szoros kapcsolatára utal ( 52. ). Ezeken felül egy új keresztmetszeti tanulmány kimutatta, hogy a depresszív tünetek és a metabolikus szindróma közti kapcsolathoz a fizikai aktivitás hozzájárul ( 53. ). Rágcsáló kísérletekből ismert, hogy a magas zsírtartalmú étrend anti-depresszáns és szorongásoldó hatású ( 54. ). Azonban az is bebizonyosodott humán és rágcsáló modell esetén, hogy a magas zsír és magas szénhidráttartalmú western diéta kognitív károsodással, elsősorban memória károsodással jár ( 55. ) és fokozza a szorongás-szerű viselkedést ( 56. ). Továbbá az elhízás hippokampusz működészavarral és epizodikus memória kieséssel jár emberben( 57. ) és rágcsálókban ( 58. ). Így az a stratégia, hogy a magas zsírtartalmú diéta segít megküzdeni a stresszel, mivel antidepresszáns és szorongásoldó hatású, hosszú távon az elhízás rizikójával jár, mely csökkent kognitív működéshez és hangulatingadozáshoz vezet.
Egyértelmű összefüggés van az étrend és a felnőttkori mentális egészség között, de jelenleg ennek sejtszintű és metabolikus háttere nem ismert.
Jelenleg nincs elég kontrollált tanulmány az összefüggések bizonyítására.
8. A mikrobiom jelentősége
Friss bizonyítékok világítottak rá a bél mikrobiom kulcsszerepére az agy működésében és fejlődésében ( 59. ). Egyre növekvő számú bizonyíték mutat rá a mikrobiom, a magzati és a születés utáni környezet kölcsönhatására és a későbbi élet során kialakuló pszichiátriai betegségekkel való kapcsolatára ( 60. ). További adatzok mutanak rá, hogy a mikrobiota kulcsszerepet játszik a stressz-reakciókban és az affektív rendellenességek (szorongás, depresszió, kognitív problémák) kialakulásában ( 61. ). Az egészséges mikrobiota szerotonin metabolizmus regulációjában betöltött szerepe is igazolni látszik ( 62. ). Valószínűnek tűnik, hogy a mikrobiom más rendellenességekben (ADHD, ASD, anorexia nervosa) is érintett ( 63. ). A stressz továbbá megzavarja a mikrobiotát és negatívan befolyásolja az emésztőrendszert: Ezért a jó minőségű étrend segít a mikrobiota szabályozásában és csökkenti a stressz és a gyulladást az agyban, következésképpen fenntartja a megfelelő kognitív működést az élet folyamán (64.) . A legutóbbi adatok megerősítették az életkorfüggő kóros idegi gyulladásos folyamatok és a kognitív hanyatlás mikrobiota segítette javulását és kimutatták, hogy prebiotikumok adása gyengíti az életkorhoz kötött microglia aktivációt ( 65. ). Hasonlóképpen serdülő patkányok stressz okozta káros viselkedési, kognitív és neurokémiai hatásait w3 többszörösen telítetlen zsírsavak (eikozapentaénsav, dokozahexaénsav. dokozapenténsav) és A-vitamin adásával normalizálni lehetett és ez a beavatkozás a mikrobiota megváltozásához is vezetett ( 66. ).
Míg a mikrobióta összetételét meghatározza a gazda genetikája és külső fatorok (pl. életstílus), az étrend és táplálkozás játssza a kulcsszerepet ebben ( 67. ). Valójában, az étrendi tényezők közvetlenül hatnak a mikrobiotára mind rágcsálókban ( 68. ), mind emberben ( 69. ) és így diétás beavatkozással a bél mikrobiota összetétele alakítható. A tanulmányok kimutatták, hogy a rostban gazdag mediterrán diéta elősegíti a diverz mikrobiota kialakulását, s ez a depresszió valószínűségét csökkenti ( 70. ). Továbbá a fermentált ételek is képesek módosítani a bél mikrobiotát, megváltoztatni a bél fiziológiát és a mentális egészséget ( 71. ). Világos tehát, hogy a mikrobiota hat a mentális egészségre, de ennek pontos mechanizmusa még nem tisztázott ( 72. ). További tanulmányok szükségesek azon étrendi komponensek azonosítására, melyek módosítani képesek az agy működését centrálisan aktív metabolitokat termelő specifikus baktériumtörzseket támogatva.
9. A táplálkozás hatásának jobb tudományos alapú értékelése irányába
Epidemiológiai tanulmányok kimutatták, hogy az étrend hatással van a mentális egészségre, és az intervenciós tanulmányok alátámasztották ezt. Még sok összefüggés vita tárgya, meggyőző bizonyítékot az oki összefüggésre nagyon nehéz találni. Keveset tudunk azokról a speciális étrendi komponensekről, melyek jótékony hatással vannak a mentális egészségre. Számos gátat kell még legyőzni. Hogy biztosan tudjuk használni a diétát a mentális egészség javítására, elvi megértés szükséges a következőkkel kapcsolatban: (1) hogyan befolyásolja a diéta a bélben zajló metabolikus folyamatokat (a mikrobiotát is beleértve), (2) hogyan hat ez a bél-agy közti jelzőrendszerre (és a bél hormonokra), (3) hogyan befolyásolja az étrend a véráramban és a célszervekben a metabolitok szintjét, (4) hogyan válaszolnak erre a sejtek és sejthálózatok (ideghálózat), (5) hogyan befolyásolja a genetikai háttér a diéta mentális egészségre gyakorolt hatását, (6) hogyan hat a diéta a gén-expresszióra és az azt követő folyamatokra. Tisztázva a metabolikus és celluláris mechanizmusokat és útvonalakat, amelyeken keresztül a táplálék támogatja a neuronok ellenállását az inzultusokkal szemben és javítja a mentális egészséget segít majd meghatározni azt, hogyan módosítsuk az étrend összetevőit úgy, hogy az segítse a mentális egészség fenntartását egy életen át.
A „táplálkozási pszichiátria” kihívása, hogy megteremtsen egy átfogó, összefüggő, szakavatott, szigorú, bizonyításon alapuló tudományt, hogy meghatározza az étrend és a táplálék szerepét a mentális egészség eltérő aspektusaiban ( 73. ).
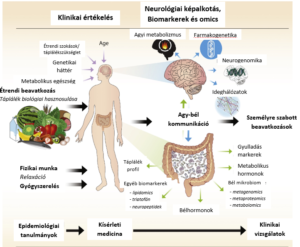
Több erőt kell befektetni nagy táplálkozási kohort tanulmányok végzésébe. Itt az ideje az adatok kibányászásának, a kohort vizsgálatokból összegyűjtött információ használatának, hogy hipotéziseket lehessen felállítani, amit a kísérletes orvostudomány módszereivel tesztelni lehet (ld. ábra). A kísérletes vizsgálatok eredménye képezi a hidat az elméleti preklinikai vizsgálatok és a klinikai tanulmányok között. Fontos, hogy a laboratóriumban végzett kísérlet tervezése egyértelmű végpontot biztosítson ( 74. )
Ábra: Integrált étrendi beavatkozás és gondoskodás affektív rendellenességekhez és kezelésükhöz
10. Új koncepciók
A táplálkozási beavatkozások különböznek a gyógyszeres kezelésektől, a gyógyszerek egy vagy kevés számú célpontra hatnak, amihez a gyógyszer nagy affinitással kötődik, amelyen szubmikromoláris koncentrációban is képes hatni. Így egyedül a vitaminok azok a tápanyagok, melyek hasonló módon tanulmányozhatók. A legtöbb tápanyagot jóval nagyobb mennyiségben fogyasztjuk, mint a gyógyszereket, kötődésük a fehérjékhez jóval kisebb, mint a gyógyszereké. Mivel a tápanyagok és metabolitjaik jóval magasabb koncentrációt ér el, így változatos célpontokhoz képesek hatni, azaz a nutriensek számos szervvben lévő több célpontra hatnak. Mialatt sok tanulmány vizsgálta ételkomponensek, ételek agyra és viselkedésre gyakorolt hatását a tudomány érdeklődése eltolódott az egyes ételkomponensektől vagy táplálék kiegészítőktől a diétamintázatok irányába ( 75. ). Ez azért fontos, mert a nutriensek együtt fejtenek hatásokat és az egyes kölcsönhatások kölcsönhatása befolyásolja biológiai hozzáférhetőségüket, nehezítve ezzel egy adott komponens szubsztrátjának beazonosítását. Az olyan táplálék kiegészítők esetén melyek az étrendben nem találhatók meg (pl. N-acetil-L-cisztein, S-adenozil-metionin), a képet tovább komplikálja, hogy bizonyos vegyületeket együttesen adva erősítik egymás hatásait, míg mások kombinálása hatástalanítja azokat ( 76. ). A legtöbb táplálkozási vizsgálatban nem alkalmaznak placébót, mivel a kontroll termék tervezés sok kihívást jelent. Könnyebb kimutatni agy adott nuriens hiányának hatását, mint hozzáadott komponens vagy étel hatását egy kontrollált helyzetben. Egy ételkomponenssel történt kiegészítés hatása kevert és nem szolgáltat erős bizonyítékot pszichiátriai betegségekben történő használatuk ( 77. ). Azokat az étrendi komponenseket (esszenciális tápanyagok), melyeket a szervezet nem képes szintetizálni, a táplálkozással szükséges bejuttatni. Az elégtelen diéta során ezekből nem jut be elegendő mennyiség. Kérdés, hogy ismerjük-e az összes ilyen anyagot. Továbbá vannak egyéni különbségek az esszenciális nutriensekre való érzékenységben és igényben. A széleskörű genom-asszociációs tanulmányok (genome wide association studies, GWAS) és meta-analízisek szerint a genetikai jellegzetességek nagy hatással vannak a vér és vizelet metabolit koncentrációra. Az egyéni étrendi javaslatoknak van nagy jelentősége. Egy újabb tanulmány felfedte az összefüggést a vér és vizelet metabolitok szabályozásában résztvevő gének és a mentális betegségek között ( 78. ). Több ilyen tanulmányra lenne szükség, a beazonosított metabolitok szintjét mérni kellene egészségesekben és betegekben. Randomizált kontrollált vizsgálatokban kellene meghatározni azokat speciális étrendi beavatkozásokat, melyek hatására ezen metabolitok szintje megváltozik. Új koncepció van kialakulóban: a genetikai adatok meghatározásával azonosítani azokat a komponenseket, melyek az étrendi beavatkozás alapját képezik és egy vagy több metabolit szérumszintjét képesek megváltoztatni adott mentális betegségben szenvedő páciensekben (ld. ábra).
11. Következtetések
A bizonyítékok egyre növekvő mennyisége alátámasztja, hogy közvetlen kapcsolat áll fenn a táplálkozás, a stresszre való érzékenység, a mentális egészség és a mentális működés között az egész életen át. Ugyan az összefüggés biztos, de hiányosságok vannak annak megértésében, hogy ezek a tényezők miként hatnak. Az elméleti háttér fejlődése, mely segít megérteni, hogyan befolyásolja az étrend a mentális egészséget és a kognitív működést fogja szolgáltatni az irányelveket az agyműködést kiegyensúlyozottá tevő étrendi beavatkozások összeállításához.
Források:
- I. Castro et al: Nutrients 2018, 10(10): 1348, https://doi.org/10.3390/nu10101348; J.C. Delpech et al.: Neuropharmacology 2015, 96: 19-28, https://doi.org/10.1016/j.neuropharm.2014.12.034; A. L. Lepinay et al.: Psychoneuroendocrinology 2015, 53: 82-93, https://doi.org/10.1016/j.psyneuen.2014.12.008.
- de la Torre et al.: The Lancet Neurology 2016, 15(8):801-810, https://doi.org/10.1016/S1474-4422(16)30034-5; T. G. Dinan et al.: Clin Nutr 2018, 38(5):1995-2001, https://doi.org/10.1016/j.clnu.2018.11.010).
- L. Aidy et al.: Clin Ther 2015, 37:954-967, https://doi.org/10.1016/j.clinthera.2015.03.002; K. V. Sandhu et al.: Trans Res 2017, 179: 223-244, https://doi.org/10.1016/j.trsl.2016.10.002; H. Shellekens et al.: Pharmacol Ther 2012, 135:316-326, https://doi.org/10.1016/j.pharmthera.2012.06.004; C. Torres-Fuentes et al.: Lancet Gastroenterol Hepatol 2017, 2:747-756, https://doi.org/10.1016/S2468-1253(17)30147-4; M van de Wouw et al.: J Nutr 2017, 147:727-745, https://doi.org/10.3945/jn.116.240481)
- Nutritional Psychiatry – J. Sarris et al.: Lancet Psychiatry 2015, 2:271-274, https://doi.org/10.1016/S2215-0366(14)00051-0 )
- G. Dinan et al.: Clin Nutr 2018, 38(5):1995-2001, https://doi.org/10.1016/j.clnu.2018.11.010
- S. Conner et al.: PLoS One 2017, 12: e0171206 cikk; S.D. Emerson, N.S. Carbert: Soc. Psychiatry Psychiatr. Epidemiol 2019, 54:567-578, https://doi.org/10.1007/s00127-018-1616-9; U. Fresan et al.: Eur J Nutr 2019, 58:1271-1282, https://doi.org/10.1007/s00394-018-1653-x; D. Moreno-Agostino et al.: Psychol Health 2019, 34:321-335, https://doi.org/10.1080/08870446.2018.1525492; R. Mujcic, J. Oswald: Am. J. Publ. Health 2016, 106:1504-1510, https://ajph.aphapublications.org/doi/full/10.2105/AJPH.2016.303260
- S. Lai et al.: Am J Clin Nutr 2014, 99:181-197, https://doi.org/10.3945/ajcn.113.069880
- Psaltopoulou et al.: Ann Neurol 2013, 74:580-591, https://doi.org/10.1002/ana.23944
- Lassale et al.: Mol Psych 2019, 24:965-986, https://doi.org/10.1038/s41380-018-0237-8
- Firth et al.: Psychosom Med 2019, 81(3):265-280, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6455094/pdf/psm-81-265.pdf
- Shafiei et al.: Nutr Rev 2019, 77:230-239, https://doi.org/10.1093/nutrit/nuy070
- G. Neal et al.: Lancet Neurol 2008, 7:500-506, https://doi.org/10.1016/S1474-4422(08)70092-9
- A.M Morris: J Inherit Metab Dis 2005, 28:109-121, https://doi.org/10.1007/s10545-005-5518-0
- Borghi et al.: Minerva Pediatr 2019, 71:181-195,https://doi.org/10.23736/s0026-4946.17.04950-7
- S Gaudio et al.: Neurosci Biobehav Rev 2016, 71:578-589, https://doi.org/10.1016/j.neubiorev.2016.09.032; V Giannunzio et al.: Eat. Disord. Rev 2018, 26:302-314, https://doi.org/10.1002/erv.2595)
- A D Smith et al.: Food Nutr. Res. 2018, 83:215-279, https://doi.org/10.1016/bs.afnr.2017.11.005; C C Tangney et al:Neurology 2011, 77: 1276-1282, https://doi.org/10.1212/WNL.0b013e3182315a33
- M M Black Food Nutr Bull 2008, 29:S126-S131, https://doi.org/10.1177/15648265080292S117
- J Hegyi et al.: Int J Dermatol 2004, 43:1-5, https://doi.org/10.1111/j.1365-4632.2004.01959x
- E M Brouwer-Brolsma et al.: J Am Med Dir Assoc 2015, 16(7):621-627, https://doi.org/10.1016/j.jamda.2015.02.013
- M Focker et al.: Eur Child Adolesc Psychiatry 2017, 26:1043-1066, https://doi.org/10.1007/s00787-017-0949-3
- N Mohammadpour et al.: Nutr Neurosci 2018, 21:202-209, https://doi.org/10.1080/1028415X.2016.1262097
- R P Bazinet and S Layé: Nat Rev Neurosci 2014, 15:771-785, https://doi.org/10.1038/nrn3820; J Firth et al.:World Psychiatry 2018, 17:365-367, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6127755/ ; A M McGrattan et al.: Curr Nutr Rep 2019, https://doi.org/10.1007/s13668-019-0271-4; M M Pusceddu et al.: Psychoneuroendocrinology 2015, 58:79-90, https://doi.org/10.1016/j.psyneuen.2015.04.015; M H Rapaport et al.: Mol Psychiatry 2016, 21:71-79, https://doi.org/10.1038/mp.2015.22
- K P Su et al.: Biol Psychiatry 2014, 76(7):559-566, https://doi.org/10.1016/j.biopsych.2014.01.008
- J C Delpech et al.: Neuropsychopharmacology 2015, 40:525-536, https://doi.org/10.1038/npp.2014.196, J C Delpech et al.: Neuropsychopharmacology 2015, 40:2774-2784, Fhttps://doi.org/10.1038/npp.2015.127; V F Labrousse et al.: PLoS One 2012, 7:e36861, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3360741/; T Larrieu et al.: Transl Psychiatry 2014, 4:e437, https://doi.org/10.1038/tp.2014.77; A L Lepinay et al.: Psychoneuroendocrinology 2015, 53:82-93, https://doi.org/10.1016/j.psyneuen.2014.12.008; M K Zamroziewicz et al.: Neuroimage 2017, 161:241-250, https://doi.org/10.1016/j.neuroimage.2017.08.043
- J T Nigg et al.: J. Am. Acad. Child. Adolesc. Psychiatry 2012, 51:86-97, https://doi.org/10.1016/j.jaac.2011.10.015
- J T Nigg et al.: J. Am. Acad. Child. Adolesc. Psychiatry 2012, 51:86-97; E J Sonuga-Barke et al.: Am J Psychiatry 2013, 170:275-289, https://doi.org/10.1176/appi.ajp.2012.12070991
- M H Bloch and A Qawasmi: J. Am. Acad. Child. Adolesc. Psychiatry 2011, 50:991-1000, https://doi.org/10.1016/j.jaac.2011.06.008; E J Sonuga-Barke et al.: Am J Psychiatry 2013, 170:275-289, https://doi.org/10.1176/appi.ajp.2012.12070991
- J J Rucklidge et al.: J. Child. Psychol. Psychiatry 2018, 59:232-246, https://doi.org/10.1111/jcpp.12817
- Del-Ponte et al.: J Affect Disord 2019, 252:160-173, https://doi.org/10.1016/j.jad.2019.04.061
- V Ly et al.: Eur. Child. Adolesc. Psychiatry 2017, 26:1067-1079, https://doi.org/10.1007/s00787-017-0959-1
- F N Jacka et al.: BMC Med 2018, 16:237, https://doi.org/10.1186/s12916-018-1228-y
- M Berk, F N Jacka: JAMA 2019, 321:842-843, doi:10.1001/jama.2019.0273; M Bot et al.: JAMA 2019, 321:858-868, doi:10.1001/jama.2019.0556
- D Gibson-Smith et al.: Eur J Nutr 2020, 59:767-778, https://doi.org/10.1007/s00394-019-01943-4
- T G Dinan et al.: Clin Nutr 2019, 38(5):1995-2001, https://doi.org/10.1016/j.clnu.2018.11.010; J M Fernandez-Real et al.: J Clin Endocrinol Metab 2015, 100:4505-4513, https://doi.org/10.1210/jc.2015-3076; S Wang et al.: Neurosci Biobehav Rev 2018, 95:191-201, https://doi.org/10.1016/j.neubiorev.2018.09.002
- C. Cunnane, M.A. Crawford: J Hum Evol 2014, 77:88-98, https://doi.org/10.1016/j.jhevol.2014.05.001
- S M Innis: Brain Res 2008, 1237:35-43, https://doi.org/10.1016/j.brainres.2008.08.078; M F Laus et al.: J. Environ. Res. Publ. Health 2011, 8:590-612, https://doi.org/10.3390/ijerph8020590; R.K. McNamara, S.E. Carlson: Prostaglandins Leukot Essent. Fatty Acids 2006, 75:329-349, https://doi.org/10.1016/j.plefa.2006.07.010; E.L. Prado, K.G. Dewey: Nutr Rev 2014, 72:267-284, https://doi.org/10.1111/nure.12102; S.J. Schwarzenberg et al.: Pediatrics 2018, 141(2): e20173716, https://doi.org/10.1542/peds.2017-3716
- T Ahmed et al.: Ann N Y Acad Sci 2014, 1332:22-38, doi: 10.1111/nyas.12487; Z A Bhutta et al.: Pediatrics 2017, 139:S12-S22, https://doi.org/10.1542/peds.2016-2828D ; R H de Groot et al.: Int J Epidemiol 2011, 40:327-337, https://doi.org/10.1093/ije/dyq261; S Dimov et al.: Nutr Neurosci 2019, https://doi.org/10.1080/1028415X.2019.1592288; L Esteban-Gonzalo et al.: B J Nutr 2019, 121:221-231, https://doi.org/10.1017/S0007114518003070; L H Lumey et al.: Annu. Rev. Publ. Health 2011, 32:237-262, https://doi.org/10.1146/annurev-publhealth-031210-101230 ; N. Mallorqui-Bague et al.: Sci Rep 2018, 8:1628, https://doi.org/10.1038/s41598-018-33843-8; E M Novak et al.: Brain Res 2008, 1237:136-145, https://doi.org/10.1016/j.brainres.2008.07.107; E.L. Prado, K.G. Dewey: Nutr Rev 2014, 72:267-284, https://doi.org/10.1111/nure.12102; M M Pusceddu et al.: Psychoneuroendocrinology 2015, 58:79-90, https://doi.org/10.1016/j.psyneuen.2015.04.015; S Roy et al.: Brain Dev 2012, 34:64-71, https://doi.org/10.1016/j.braindev.2011.01.002
- Castanys-Munoz et al.: Acta Paediatr 2017, 106:1230-1238, doi: 10.1111/apa.13868; K K Ong et al.: Acta Paediatr 2015, 106:974-986, https://doi.org/10.1111/apa.13128
- K. Georgieff et al.: Acta Paediatr 2018, 107:1310-1321, https://doi.org/10.1111/apa.14287
- I Velasco et al.: Nutrients 2018, 10(3):290, https://doi.org/10.3390/nu10030290
- G Blasco et al.: J Clin Endocrinol Metab 2017, 102:2962-2973, https://doi.org/10.1210/jc.2017-00133
- C Algarin et al.: Front Aging Neurosci 2017, 7:54, https://doi.org/10.3389/fnagi.2017.00054
- A Oosting et al.: J Nutr Sci 2015, 4:e19, https://doi.org/10.1017/jns.2015.13
- R Frredman et al.: Am J Psychiatry 2018, 175:607-619, https://doi.org/10.1176/appi.ajp.2018.17070836; L Schipper et al.: Prostaglandins Leukot Essent. Fatty Acids 2016, 110:8-15, https://doi.org/10.1016/j.plefa.2016.05.001
- G Provensi et al.: Natl. Acad. Sci. U.S.A 2019, 116:9644-9651, https://doi.org/10.1073/pnas.1820832116
- S M O’Mahony et al.: Eur J Neurosci 2020, 51:1042-1045, https://doi.org/10.1111/ejn.14514
- A Smyth et al.: Neurology 2015, 84:1-8, https://doi.org/10.1212/WNL.0000000000001638
- S D Anton et al.: Exp Gerontol 2014, 57:181-187, https://doi.org/10.1016/j.exger.2014.05.015; C Valls-Pedret et al.: J Alzheimers Dis 2012, 29:773-782, DOI: 3233/JAD-2012-111799; A V Witte et al: J Neurosci 2014, 34:7862-7870, https://doi.org/10.1523/JNEUROSCI.0385-14.2014
- C Valls-Pedret et al.: JAMA Intern Med 2015, 175(7):1094-1103, doi:10.1001/jamainternmed.2015.1668)
- K Wu et al.: Neuroscience 2016, 333: 345-355, https://doi.org/10.1016/j.neuroscience.2016.07.038
- Agrawal, F. Gomez-Pinilla et al.: J Physiol 2012, 590:2485-2499, https://doi.org/10.1113/jphysiol.2012.230078; J A Prenderville et al.: Trends Neurosci 2015, 38:13-25, https://doi.org/10.1016/j.tins.2014.11.001
- M F Dallman: Trend Endocrinol Metab 2010, 21:159-165, https://doi.org/10.1016/j.tem.2009.10.004; E L Gibson: Physiol Behav 2006, 89:53-61, https://doi.org/10.1016/j.physbeh.2006.01.024; G. Oliver, J. Wardle: Physiol Behav 1999 66:511-515, https://doi.org/10.1016/S0031-9384(98)00322-9)
- J Matta et al.: J Affect Disord 2019, 244:25-32, https://doi.org/10.1016/j.jad.2018.09.072
- B C Finger et al.: Neuroscience 2011, 192:351-360, https://doi.org/10.1016/j.neuroscience.2011.06.072; D D Leffa et al.: Metab Brain Dis 2015, 30:1073-1082, https://doi.org/10.1007/s11011-015-9682-0)
- Attuquayefi et al.: PLoS One 2017, 12:2-e0172645, 10.1371/journal.pone.0172645.;S E Kanoski et al.: Behav Brain Res 2007, 182:57-66, https://doi.org/10.1016/j.bbr.2007.05.004
- F Peris-Sampedro et al.: Obesity 219, 27:409-419, https://doi.org/10.1002/oby.22381
- L G Cheke et al.: Q J Exp Physiol 2016, 69:2305-2316, https://doi.org/10.1080/17470218.2015.1099163; Higgs, M.S. Spetter: Curr Obes Rep 2018, 7:50-59, https://doi.org/10.1007/s13679-018-0296-9
- S A Farr et al.: Endocrinology 2008. 149: 2628-2636, https://doi.org/10.1210/en.2007-1722; F D Heyward et al.: Neurobiol Learn Mem 2012, 98:25-32, https://doi.org/10.1016/j.nlm.2012.04.005; W D Porter et al.: Int J Obes 2013, 37:678-684, https://doi.org/10.1038/ijo.2012.91
- G Blasco et al.: J Clin Endocrinol Metab 2017, 102:2962-2973, https://doi.org/10.1210/jc.2017-00133; T.G. Dinan, J.F. Cryan: Psychoneuroendocrinology 2012, 37:1369-1378, https://doi.org/10.1016/j.psyneuen.2012.03.007; S Mörkl et al: Neuropsychobiology 2020, 79:80-88, https://doi.org/10.1159/000492834; J M Fernandez-Real et al.: J Clin Endocrinol Metab 2015,100:4505-4513, https://doi.org/10.1210/jc.2015-3076
- M G Codagnone et al.: Biol Psychiatry 2019, 85:150-163, https://doi.org/10.1016/j.biopsych.2018.06.014
- T F S Bastiaanssen et al.: Int J Neuropsychopahrmacol 2019, 22:37-52, https://doi.org/10.1093/ijnp/pyy067; F. Cryan, T.G. Dinan: Nat Rev Neurosci 2012, 13:701-712, https://doi.org/10.1038/nrn3346; E E Noble et al.: Front Behav Neurosci 2017, 11:9, https://doi.org/10.3389/fnbeh.2017.00009; D Silva et al.: Dement Geriatr Cogn Dis Extra 2012, 2:120-131, https://doi.org/10.1159/000336224
- S M O’Machony et al.: Behav Brain Res 2015, 277:32-48, https://doi.org/10.1016/j.bbr.2014.07.027
- M C Cenit et al.: Eur Child Adolesc Psychiatry 2017, 26:1081-1092, https://doi.org/10.1007/s00787-017-0969-z; B. Herpertz-Dahlmann et al.: Eur Child Adolesc Psychiatry 2017, 26:1031-1041, https://doi.org/10.1007/s00787-017-0945-7; V Ly et al.: Eur Child Adolesc Psychiatry 2017, 26:1067-1079, https://doi.org/10.1007/s00787-017-0959-1
- F Haghighatdoost et al.: Clin Nutr 2019, 38:1643-1650, https://doi.org/10.1016/j.clnu.2018.08.016; K Tolkien et al.: Clin Nutr 2019, 38(5):2045-2052, https://doi.org/10.1016/j.clnu.2018.11.007; J Wang et al.: Publ Health Nutr 2019, 22(4):654-660, https://doi.org/10.1017/S1368980018002628)
- M Boehme et al.: Mol Psychiatry 2019, https://doi.org/10.1038/s41380-019-0425-1
- G Provensi et al.: Proc Natl Acad Sci USA 2019, 116:9644-9651, https://doi.org/10.1073/pnas.1820832116
- L A David et al.: Nature 2014, 505:559-563, https://doi.org/10.1038/nature12820; K J Portune et al.: Mol Nutr Food Res 2016, https://doi.org/10.1002/mnfr.201600252; P J Turnbaugh et al.: Sci Transl Med 2009, 1(6):6ra14, DOI:1126/scitranslmed.3000322; Xu Z., R. Knight: Br J Nutr 2015, 113(Suppl):S1-S5, https://doi.org/10.1017/S0007114514004127
- H Daniel et al.: ISME J 2014, 8:295-308, https://doi.org/10.1038/ismej.2013.155; N de Wit et al.: Am. J. Physiol Gastrointest Liver Physiol 2012, 303:G589-G599, https://doi.org/10.1152/ajpgi.00488.2011; T M Marques et al.: Br J Nutr 2013, 113:728-73, https://doi.org/10.1017/S0007114514004206; R J Mujico et al.: Br J Nutr 2013, 110:711-720, https://doi.org/10.1017/S0007114512005612; E F Murphy et al.: Gut 2010, 59:1635-1642, http://dx.doi.org/10.1136/gut.2010.215665; E Patterson et al.: Br J Nutr 2014, 111:1905-1917, https://doi.org/10.1017/S0007114514000117; Y Ravussin et al.: Obesity 2012, 20:738-747, https://doi.org/10.1038/oby.2011.111
- C De Filippo et al.: Proc Natl Acad Sci USA 2010, 107:14691-14696, https://doi.org/10.1073/pnas.1005963107; P J Turnbaugh ert al.: Sci Transl Med 2009, 1:6ra14, DOI: 10.1126/scitranslmed.3000322; Xu Z., R. Knight: Br J Nutr 2015, 113(Suppl):S1-S5, https://doi.org/10.1017/S0007114514004127
- B Gopinath et al.: J Gerontol A Biol Sci Med Sci 2016, 71:1335-1340, https://doi.org/10.1093/gerona/glw091
- H Aslam et al.: Nutr Neurosci 2018, https://doi.org/10.1080/1028415X.2018.1544332
- M Scriven et al.: Diseases 2018, 6:78, https://doi.org/10.3390/diseases6030078
- F N Jacka et al.: BMC Med 2017, 15:23, https://doi.org/10.1186/s12916-017-0791-y; W Marx et al.: Proc Nutr Soc 2017, 76(4):427-436, https://doi.org/10.1017/S0029665117002026; J Sarris et al.: Lancet Psychiatry 2015, 2:271-274, https://doi.org/10.1016/S2215-0366(14)00051-0; J Sarris et al.: World Psychiatry 2015, https://doi.org/10.1002/wps.20223
- G R Dawson et al.: J Psychopharmacol 2011, 25:1145-1147, https://doi.org/10.1177/0269881111415342
- F B Hu: Curr Opin Lipidol 2002, 13:3-9
- J Sarris: Drugs 2019, 79:929-934, https://doi.org/10.1007/s40265-019-01134-9
- J Sarris: Drugs 2019, 79:929-934, https://doi.org/10.1007/s40265-019-01134-9
- J Hebebrand et al.: Mol Metab 2018, 12:1-11, https://doi.org/10.1016/j.molmet.2018.03.015



