A nem alkoholos zsírmáj és a steatohepatitis
Szerző: Dr. Krkos Károly
A nem-alkoholos zsírmáj (non-alcoholic fatty liver disease – NAFLD) az utóbbi 4 évtized alatt a leggyakoribb krónikus májbetegséggé vált (a felnőtt lakosság mintegy 25%-át érinti világszerte). Bár a betegségben szenvedők kevesebb, mint 10%-ában fejlődik ki májjal kapcsolatos komplikáció, a kihívást azoknak a NAFLD betegeknek a biztos kiválasztása jelenti, akik a nagykockázatú csoportba tartoznak. Az állapot gyakori előfordulása miatt gyorsan növekszik a májbetegség miatti halálozás. Mindezek ellenére a NAFLD alul értékelt rendellenesség3.
A betegség definíciója inkább kizáráson alapul: a májsejtek >5%-ában szteatózis figyelhető meg a metabolikus rizikótényezők (elhízás, 2 típusú diabetes mellitus) megléte mellett, amennyiben a kifejezett alkoholfogyasztás (férfiaknál >30 g/nap, nőknél >20 g/nap) kizárható és más krónikus májbetegség nem áll fenn3. 2020-ban felmerült a metabolikus diszfunkció asszociált zsírmáj betegség (MAFLD) kifejezés használata, de ez az elnevezés nem vált általánossá3,7.
A nem-alkoholos zsírmáj betegség egy heterogén csoport összefoglaló neve, melyben kontinuum figyelhető meg: folytonos az átmenet a gyulladás nélküli, az enyhe gyulladással járó szteatózis és a nekroinflammáció jeleit mutató nem-alkoholos májgyulladás (NASH) között, mely utóbbiból cirrózis és májrák alakulhat ki (1. ábra). A betegség progressziója és a kezelésre történő reagálása heterogén. A májfibrózis kiterjedésének becslése fontos a súlyosság és a prognózis megítélése szempontjából. Metabolomikai és genomikai vizsgálatok tesznek lehetővé pontosabb értékelést25.
1.ábra: Nem-alkoholos zsírmáj betegség (NAFLD) kontinuum (3. irodalmi utalás alapján)
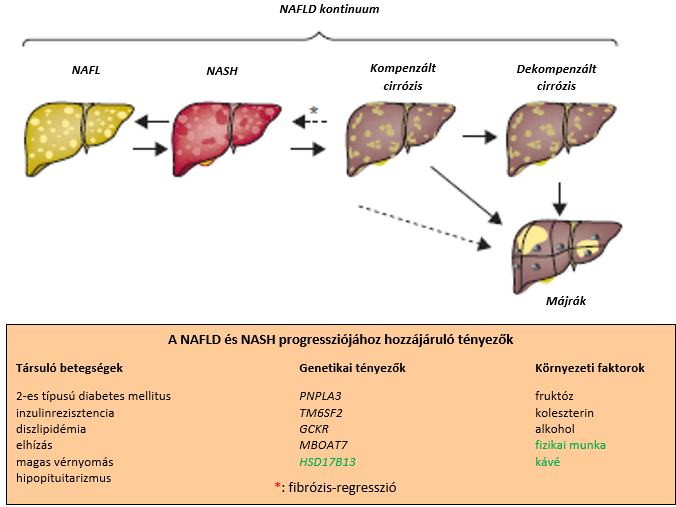
A feketével írt tényezők a NAFLD és a NASH progressziójához hozzájárulnak, a zölddel írtak védőfaktorok.
NAFL: nem-alkoholos zsírmáj; NAFLD: nem-alkoholos zsírmáj betegség; NASH: nem-alkoholos steatohepatitis;
Jelen epidemiológiai adatok szerint a prevalencia 13,8%-tól (Afrika) 31,8%-ig (Közel-Kelet) terjed. A különbség a kalóriabevitellel, a fizikai aktivitással, a testzsír eloszlással, a szocioökonómiai státusszal és a genetikai jellemzőkkel magyarázható. Szoros összefüggés mutatható ki a betegség és a metabolikus szindróma között: a 2-es típusú cukorbetegek 47,3 – 63,7 %-ában, az elhízottak mintegy 80%-ában figyelhető meg az állapot. Ennek ellenére egészséges BMI (fehérek: <25 kg/m2, ázsiaiak : <23 kg/m2) mellett is előfordulhat (non-obes NAFLD). A páciensek kevesebb, mint 10%-ában alakul ki cirrózis vagy májrák, 10-20 évvel a diagnózist követően. Egyéb (alkohol-okozta, vírusfertőzés miatti vagy autoimmun) eredetű májbetegség az állapotra szinergista hatású. A NAFLD betegek mortalitása csak enyhén magasabb, mint az általános populációé. A betegség a legtöbb esetben stabil, vagy lassan progrediál, nem vezet cirrózishoz és máj okozta halálozáshoz. A fibrózis kialakulása mind a NAFL, mind a NASH betegekben megfigyelhető, de a NASH csoportban gyorsabb. A fibrózis értékelésének közvetlen módja a máj biopsziás minta szövettani értékelése, mely szerint 0 (nincs fibrózis) – 4 (cirrózis) stádium állapítható 3,28. A fibrózis mértékének megállapítása a fő prognosztikai paraméter a májbetegség okozta kimenetel becslésében. A cirrózis stádiumban a NASH tipikus klinikai képe már nem látható, így mikor más betegséggel nem magyarázható az állapot (kriptogén cirrózis) és metabolikus betegséggel társul, „kiégett” NASH névvel illetik. Nem ritka, hogy a NASH-t csak akkor ismerik fel, mikor portalis hipertónia (lépmegnagyobbodással, alacsony vérlemezke számmal) vagy egyéb májjal kapcsolatos komplikáció alakult ki. A kompenzált cirrózisok mintegy 3-4%-a válik évente dekompenzálttá (ascites, hepaticus encephalopathia, nyelőcső- és gyomorvérzések)3. 10,6/ 1000 esetben alakul a NASH-cirrózisból májrák, ugyanakkor a NAFLD-eredetű májrákok mintegy 20%-a nem-cirrótikus betegségből alakul ki 3. A nem cirrótikus eredetű hepatocellularis rák incidenciája alacsony: 0,08/1000 személy/év. A NAFLD a végstádiumú májbetegség vezető oka, a primer májrák második leggyakoribb oka3,30.
A progresszív májbetegséget leszámítva a NAFLD-halálozás vezető oka a szív és érrendszeri betegség, ezt az extrahepatikus rosszindulatú daganatok (bélrákok vagy emlőrák) követik. A szív-érrendszeri betegségek és a NAFLD közti kapcsolat nem teljesen tisztázott, de nagy valószínűséggel a metabolikus szindróma, a hipertónia az aterogén lipidprofil tartozik a fő tényezők közé. A NAFLD betegekben 1,9-szer gyakoribb a (gyomor-bél rendszeri, máj-, méh-) rák előfordulása, melyben valószínűleg a visceralis adipozitásnak és a krónikus alacsony szintű gyulladásnak van szerepe.
Patogenezis
A NAFLD legfőbb patogenetikai tényezője a túltáplálás. Az inzulinrezisztencia miatti változatlan májsejt zsírfelvétel és a fokozott de novo lipogenezis legyőzi a máj metabolikus kapacitását. A lipid-metabolizmus egyensúlyának megbomlása lipotoxikus lipidek keletkezéséhez vezet, mely hozzájárul a celluláris stresszhez, inflammaszóma aktiválódáshoz, apoptótikus sejtpusztuláshoz, következményes gyulladáshoz, szöveti regenerációhoz és fibrogenezishez. Ezek a folyamatok több metabolikus, genetikai és mikrobiom-függő tényezőből tevődnek össze, melyek jelenleg még nem pontosan ismertek. A genetikai tényezők a betegség rizikójában 20-70%-ban játszanak szerepet. A legjobban karakterizált SNP, melynek a NAFLD- patogenezisében szerepe van a PNPLA3 gén variánsa. Az eddig ismert SNP-k az öröklődési hajlamnak csak 10-20%-át fedik le. A megváltozott bél mikrobiomból származó metabolitok hozzájárulnak a fibrózishoz, gyulladáshoz (lipopoliszacharidok, rövidláncú zsírsavak, epesav metabolitok)3,35.
A betegség súlyosságának becslése
A NAFLD diagnózisát legtöbbször képalkotó módszerrel, klinikai rizikó pontszámok (pl. fatty liver index) alapján vagy a biopszás minta szövettani értékelése során vetik fel. Leggyakrabban a has ultrahang vizsgálatakor merül fel a nem-alkoholos zsírmáj kórisme: világos máj echotextúra és elmosódott erek láthatók. Az UH vizsgálat két limitációja: 1) az előrehaladott fibrózis hatására durvábbá válik az echotextúra és az elmosódott erezet, 2) az eljárás nem elég érzékeny – csak 30% feletti szteatózis érzékelhető. Az MRI- módszer a szteatózis mérésére (MRI proton density fat fraction) sokkal érzékenyebb (már 5% feletti szteatózist kimutat), azonban jelenleg csak tudományos célokra és a NASH kezelésének értékelésére használják.
A progresszív betegség rizikótényezői között a 2-es típusú diabétesz (T2DM) jelentős helyet foglal el: megléte kétszeres fibrózis rizikóval, cirrózis komplikációval és májbetegség halálozással jár3,16,54. Az elhízás (BMI> 30 kg/m2), lipid abnormalitások, (alacsony HDL-koleszterin, magas triglicerid), magas vérnyomás szintén kockázati tényezők, de hatásuk kisebb mértékű a T2DM-hez viszonyítva. A 60 éven felüliek fibrózisa jelentősebb, mint a fiatalabbaké. A PNPLA3 gén variáns súlyosabb szövettani képpel, a hepatocellularis carcinoma kialakulásának nagyobb valószínűségével, magasabb máj-okozta és össz-mortalitással társul3. A T2DM nélkül előforduló NAFLD előre- jelzésére a tömegspektrometriás módszerrel mért éhomi inzulinszint alkalmas24. A modern diagnosztikában a metabolomikai és lipidomikai meghatározásokat is igyekeznek hadrendbe állítani25.
A T2DM előrejelzésére több rizikóbecslő modell létezik. A prediabétesz rizikó pontszámok a következő paramétereket veszik számításba: nem, életkor, BMI, derékbőség, családi előfordulás, rassz, szisztolés és diasztolés vérnyomás, pulzusszám, koleszterin, triglicerid, HDL, éhomi vércukor, HbA1c10b.
A klinikusok gyakran non-invaziv tesztek eredményeiből származtatott indexeket alkalmaznak a betegség súlyosságának értékelésére (1. táblázat). Klasszikusan a májbiopszia szövettani értékelése (szteatózis, gyulladás, májsejt felpuffadás, fibrózis mértékének megállapítása) lenne a kórismézés megbízható módja, de ez invaziv módszer és nem mentes az intra- és interobszerver variabilitástól3,25. A fibrózis mértéke korrelál legjobban a májeredetű morbiditással és mortalitással. A nem-invaziv módszerek közül a NAFLD fibrózis score (NFS) és a fibrózis-4 index (FIB-4) negatív prediktív értéke kellően nagy (az előrehaladott fibrózis kizárásában)3. További, laboratóriumi markerekből számítható indexek az Enhanced Liver Fibrosis (ELF)1,3, illetve composite ELF (cELF)2 score, ProC3 (a fibrózis kialakulásának folyamatában a III típusú kollagénből proteáz okozta hasítás révén keletkező neoantigén4b) méréssel kiegészített ADAPT index4, a NIS4 algoritmus6 (NIS4) jobb érzékenységet, nagyobb ROC (receiver operating characteristic) görbe alatti területet (AUROC) ér el.
A fibrózis becslésének másik csoportját a máj keménységének értékelése jelenti. Ezek közül a legelterjedtebb a májkeménység mérés vibráció-kontrolált tranziens elasztográfiával (liver stiffness by vibration controlled transient elastography, LS by VCTE), ezen kívül ez a paraméter kétdimenziós nyíróhullám elasztográfiával és MR elasztográfiával is megbecsülhető3,15,22,23,29. A májkeménységgel együtt a szteatózis is értékelhető kontrolált attenuációs paraméter méréssel (FibroScan). A kapott értékek nemcsak a májcirrózis komplikációk de a májrák kialakulásának kockázatával is jól korrelálnak. A hepatocellularis carcinoma rizikójának monitorozására a szérum vas szint is segítséget nyújthat33. Ezeknek a paramétereknek további kibővítése vagy érzékenyebb becslést tesz lehetővé (FAST score) vagy terápiás beavatkozás elvégzésében segít dönteni (Baveno VI kritériumok: LS by VCTE ≥20 kPa + vérlemezkeszám <150*109 → kezelésre szoruló varikozitás)3,5. További laboratóriumi paraméter a májfibrózis előrejelzésére a növekedési differenciációs faktor-15 (growth differentiation factor-15, GDF15)20. Az isthmin nevű adipokin a glukóz toleranciát és a máj zsírosodást javítja21, szintje valószínűleg az egyensúlyi, nem progrediáló betegséggel korrelál.
A betegség prevenciója
A betegség megelőzésének fontossága különösen jelentős, figyelembe véve, hogy jelenleg csekély terápiás lehetőség áll rendelkezésre. A megelőzés fő lehetőségeit a diéta minőségének javítása és a fenntartott vagy fokozott fizikai aktivitás jelenti.
Mindenképpen fontos az elhízottak, a 2-es típusú cukorbetegek, vagy metabolikus szindrómában szenvedők csoportjában valamilyen non-invaziv módszer alkalmazásával a NAFLD/NASH/májfibrózis értékelése. Ha a NASH diagnózisa bebizonyosodott, az előrehaladott fibrózis és cirrózis kizárása mellett a szív-érrendszeri rizikótényezők és egyéb komorbid állapotok feltérképezése is szükséges.
Amennyiben a nem-alkoholos zsírmáj lehetősége felmerül, először az egyszerű, non-invaziv módszereket (NFL, FIB4) tanácsos alkalmazni az előrehaladott fibrózis kizárására. A negatív csoportba tartozókat nyomon kell követni (legalább 3-5 évente kell ismételni a méréseket). Amennyiben az előbb említett paraméterek alapján a páciens az átmeneti vagy valószínűen előrehaladott fibrózis csoportba kerül, további vizsgálatok (elasztográfia, ELF, NIS4, ADAPT, FAST) válnak szükségessé. Mivel a 2. típusú diabéteszesek között a betegség prevalenciája különösen magas (40-70%), továbbá mivel a cukorbeteg gondozottak körében az előrehaladott fibrózis 10-20%-ban fordul elő, nekik szorosabb nyomon követésre és a komorbid állapotok rendszeres multidiszciplináris ellenőrzésére van szükség3,31,32,53,57,60.



A nem-alkoholos zsírmáj kezelése
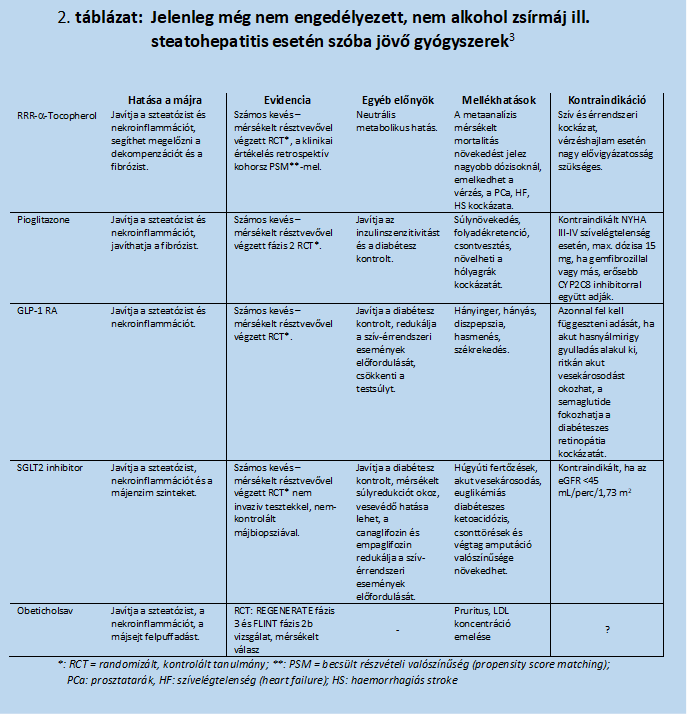
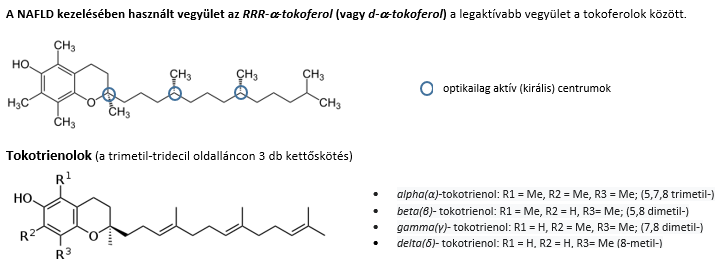
A terápia alapköve a prevenciónál már említett minőségi étrend50,55, a bőséges folyadékbevitel51 és a fizikai aktivitás – ezek a metabolikus szindróma javításában, testsúly csökkentésében alapvetőek. Súlyos obezitás esetén a súlycsökkentő műtétek is szóba jöhetnek44,45 . Jelenleg nem áll rendelkezésre egyetlen FDA (Food and Drug Administration, US) vagy EMA (European Medicine Agency) által engedélyezett gyógyszer sem. Több kísérleti stádiumban lévő anyag vizsgálata még nem záródott le, ezek a 2. táblázatban3 találhatók összefoglalva. A NASH kezelésére szánt szerek megfelelő értékelésének feltételei J V Lazarus és munkatársdai cikkeiben47,53 olvashatók. Az értékélésnél a nemi különbségek figyelembe vételének fontosságát is hangsúlyozzák19. A vizsgálatok végpontjaként vagy a steatohepatitis javulását a fibrózis romlása nélkül, vagy a fibrózis javulását a steatohepatitis romlása nélkül jelölték meg3,47. A vizsgált gyógyszerek között szerepel az E-vitamin komplexbe (ld. függelék) tartozó RRR-α-tokoferol; a T2DM kezelésében alkalmazott thiazolidindione, a pioglitazone, a GLP-1 receptor agonisták (semaglutide, liraglutide) az SGLT2-gátlók (canaglifozin, dapaglifozin, empaglifozin)17,56,58; az obeticholsav, és kombináltan a cilofexor – firsocostat3. Kísérletek folynak a pán-PPAR agonista Lanifibranorral36,37, a Terns Pharmaceutical TERN-101-nek nevezett farnezoil X receptor agonistájával38. Elméletileg más célpontra (pl. galectin-3-ra46) ható szerek is felmerültek.
Egyebek: Az US-ban próbálkoznak a LiverLuv nevű étrendkiegészítővel (ld. függelék). Megfigyelték a kávéfogyasztás és a rövid láncú zsírsavak (SCFA) kedvező hatását is48,49,59.
Irodalom
1. Q M Anstee, E J Lawitz: Noninvasive Tests Accurately Identify Advanced Fibrosis due to NASH: Baseline Data From the STELLAR Trials, Hepatology 2019, 70(5):1521-1530, doi: 10.1002/hep.30842
2. V Nobili, J Parkes et al.: Performance of ELF Serum Markers in Predicting Fibrosis Stage in Pediatric Non-Alcoholic Fatty Liver Disease 2009, 136:160-167, 10.1053/j.gastro.2008.09.013
3. E E Powell, V Wai-Sun Wong, M Rinella: Non-alcoholic fatty liver disease 2021, https://doi.org/10.1016/ S0140-6736(20)32511-3
4. S J Daniel, D J Leeming et al.: ADAPT: An algorithm incorporating PRO-C3 accurately identifies patients with NAFLD and advanced fibrosis 2019, 69(3):1075-1086, doi: 10.1002/hep.30163
4b M Boyle, D Tiniakos et al.: Performance of the PRO-C3 collagen neo-epitope biomarker in non-alcoholic fatty liver disease 2019, JHEP
Reports, https://doi.org/10.1016/j.jhepr.2019.06.004
5. P N Newsome, M Sasso et al: FibroScan-AST (FAST) score for the non-invasive identification of patients with non-alcoholicsteatohepatitis with significant activity and fibrosis: a prospective derivation and global validation study 2020, Lancet Gastroenterology and Hepatology, 5(4):362-373, doi: 10.1016/S2468-1253(19)30383-8
6. S A Harrison, V Ratziu et al.: A blood-based biomarker panel (NIS4) for non-invasive diagnosis of non-alcoholic steatohepatitis and liver fibrosis: a prospective derivation and global validation study 2020, https://doi.org/10.1016/S2468-1253(20)30252-1
7. 7 J Semmler, S Wernly et al: Metabolic Dysfunction-Associated Fatty Liver Disease (MAFLD)—Rather a Bystander Than a Driver of Mortality 2021, JCEM, 106(9):2670-2677, doi:10.1210/clinem/dgab339
8. M D Muthiah, N C Han, A J Sanyal: A clinical overview of non-alcoholic fatty liver disease: A guide to diagnosis, the clinical features, and complications—What the non-specialist needs to know 2021, Diabetes Obes Metab, DOI: 10.1111/dom.14521
9. J H Shubrook: Fatty Liver: Managing a Silent Epidemic in Primary Care 2021, Medscape, https://www.medscape.com/viewarticle/958321
10. W Pass: AGA Clinical Care Pathway: Screening, Diagnosis, and Treatment of NAFLD and NASH 2021, Medscape, https://www.medscape.com/viewarticle/963308
10b A Martinez-Millana, M Argente-Pla et al: Driving Type 2 Diabetes Risk Scores into Clinical Practice: Performance Analysis in Hospital
Settings 2019, J Clin Med, 8:107-126, doi:10.3390/jcm8010107
11. T Brand, I C Lamberta van den Munckhof et al: Superficial vs Deep Subcutaneous Adipose Tissue: Sex-Specific Associations With Hepatic Steatosis and Metabolic Traits 2021, JCEM 106(10):e3881-e3889, doi:10.1210/clinem/dgab426
12. G Targher, K E Corey et al: The complex link between NAFLD and type 2 diabetes mellitus — mechanisms and treatments 2021, Nature Rviews Gastroenterology & Hepatology, https://doi.org/10.1038/s41575-021-00448- y
13. D Barb, E M Repetto et al: Type 2 diabetes mellitus increases the risk of hepatic fibrosis in individuals with obesity and nonalcoholic fatty liver disease 2021, Obesity, 29:1950-1960, DOI: 10.1002/oby.23263
14. H Yki-Järvinen, P K Luukkonen et al: Dietary carbohydrates and fats in nonalcoholic fatty liver disease 2021, Nature Review Gastroenterology & Hepatology, https://doi.org/10.1038/s41575-021-00472- y
15. A Andersson, M Kelly et al: Clinical utility of MRI biomarkers for identifying NASH patients at high risk of progression: A multi-center pooled data and meta-analysis 2021, Clinical Gastroenterology and Hepatology, https://doi.org/10.1016/j.cgh.2021.09.041
16. C C Cohen, W Perng et al: Hepatic Fat in Early Childhood Is Independently Associated With Estimated Insulin Resistance: The Healthy Start Study 2021, JCEM 106(11):3140-3150, https://doi.org/10.1210/clinem/dgab541
17. P Borodavkin, W Sheridan et al: Effects of glucagon-like peptide-1 receptor agonists on histopathological and secondary biomarkers of non-alcoholic steatohepatitis: A systematic review and meta-analysis 2021, Diabetes Obes Metab 2021, DOI: 10.1111/dom.14565
18. S Kawata, A Nakamura et al: Glucokinase activation leads to an unsustained hypoglycaemic effect with hepatic triglyceride accumulation in db/db mice 2021, Diabetes Obes Metab, DOI: 10.1111/dom.14586
19. P Lefebre, B Staels: Hepatic sexual dimorphism — implications for non- alcoholic fatty liver disease 2021, https://doi.org/10.1038/s41574-021-00538-6
20. J Bilson, E Scorletti et al: Growth differentiation factor-15 and the association between type 2 diabetes and liver fibrosis in NAFLD 2021, Nutrition & Diabetes 11:32, https://doi.org/10.1038/s41387-021-00170-3
21. Z Jiang, M Zhao et al: Isthmin-1 is an adipokine that promotes glucose uptake and improves glucose tolerance and hepatic steatosis 2021, 33:1836-1852, https://doi.org/10.1016/j.cmet.2021.07.010
22. A Andersson, M Kelly et al: Clinical Utility of MRI Biomarkers for Identifying NASH Patients at High Risk of Progression: A Multicenter Pooled Data and Meta-Analysis 2021, Clinical Gastroenterology and Hepatology, https://doi.org/10.1016/j.cgh.2021.09.041
23. D Swift: Andrea Dennis on MRI Biomarkers for Identifying Progression to NASH – Quantitative MRI-based tests are non-invasive and effective 2021, MesPage Today, https://www.medpagetoday.com/reading-room/aga/lower-gi/95233
24. F Bril, M J McPhaul et al: Intact Fasting Insulin Identifies Nonalcoholic Fatty Liver Disease in Patients Without Diabetes 2021, JCEM 106(11):e4360-e4371, doi:10.1210/clinem/dgab417
25. M Masoodi, A Gastaldelli et al: Metabolomics and lipidomics in NAFLD: biomarkers and non-invasivediagnostic tests 2021, Nature Review Gastroenterology and Hepatology 18:835-856, https://doi.org/10.1038/s41575-021-00502-9
26. A Drolz, S Wolter et al: Performance of non-invasive fibrosis scores in non-alcoholic fatty liver disease with and without morbid obesity 2021, International Journal of Obesity, 45:2197-2204, https://doi.org/10.1038/s41366-021-00881-8
27. Z M Younossi, S Felix et al: Performance of the Enhanced Liver Fibrosis Test to Estimate Advanced Fibrosis Among Patients With Nonalcoholic Fatty Liver Disease 2021, JAMA Network Open, 4(9):e2123923. doi:10.1001/jamanetworkopen.2021.23923
28. T Poynard, V Paradis et al: Prospective External Validation of a New Non-invasive Test for theDiagnosis of Non-alcoholic Steatohepatitis in Patients With Type 2Diabetes 2021, Aliment Pharmacol Ther., 54(7):952-966, https://www.medscape.com/viewarticle/958927
29. N Tamaki, V Ajmera, R Loomba: Non-invasive methods for imaging hepatic steatosis and their clinicalimportance in NAFLD 2022, Nature Reviews Endocrinology, 18:55-66, https://doi.org/10.1038/s41574-021-00584-0
30. A J Sanyal, M L Van Natta et al: Prospective Study of Outcomes in Adults with Nonalcoholic Fatty Liver Disease 2021, N Engl J Med, 385:1559-1569, DOI: 10.1056/NEJMoa2029349
31. G Zuo, L Xuan et al: New Nonalcoholic Fatty Liver Disease and Fibrosis Progression Associate With the Risk of Incident Chronic Kidney Disease 2021, JCEM, 106(10):e3957-e3968, https://doi.org/10.1210/clinem/dgab425
32. S A Polyzos, S Kechagias, E A Tsochatzis: Non-alcoholic Fatty Liver Disease and Cardiovascular Diseases 2021, Aliment Pharmacol Ther., 54(8):1013-1025, https://www.medscape.com/viewarticle/960741
33. Z Hamza, S Writer: Clinical surveillance of serum iron levels may be worth monitoring, researcher says, 2021 MedPage Today https://www.medpagetoday.com/meetingcoverage/aasld/95645
34. T J Oh, K Kim et al: Liver Fibrosis Indices for the Prediction of Mortality in Korean Subjects: A 16-Year Prospective Cohort Study 2021, 10:1-8, https://doi.org/10.1210/jendso/bvab123
35. J I Martínez-Montoro, M S Kuchay et al: Gut microbiota and related metabolites in the pathogenesis of nonalcoholic steatohepatitis and its resolution afterbariatric surgery 2021, Obesity Reviews, https://doi.org/10.1111/obr.13367
36. S M Francque, P Bedossa et al: A Randomized, Controlled Trial of the Pan-PPAR Agonist Lanifibranor in NASH 2021, N Engl J Med, 385:1547-1558, DOI: 10.1056/NEJMoa2036205
37. M Brooks: Novel Drug Lanifibranor Promising for Nonalcoholic Steatohepatitis 2021, ttps://www.medscape.com/viewarticle/961293
38. R Loomba, A K Singal: Data on TERN-101 Show Promise for NASH Treatment 2021, Gastroenterology & Endoscopy News 2021, https://www.gastroendonews.com/Article/PrintArticle?articleID=64811
39. A Aminian, A Al-Kurd et al: Association of Bariatric Surgery With Major Adverse Liver and Cardiovascular Outcomes in Patients With Biopsy-Proven Nonalcoholic Steatohepatitis 2021, JAMA, 326(20):2031-2042. doi:10.1001/jama.2021.19569
40. K E Corey, Z N Memel: Bariatric Surgery as a Strategy for Improving Outcomes in Nonalcoholic Steatohepatitis 2021, JAMA 326(20):2015-2017. doi:10.1001/jama.2021.17451
41. K A Seeberg, H Borgeraas et al: Do Gastric Bypass and Sleeve Gastrectomy Help Reduce Liver Fat Content and Scarring in Patients With Type 2 Diabetes? 2022, https://doi.org/10.7326/P21-0012
42. N Finer: Weight loss interventions and nonalcoholic fatty liver disease: Optimizing liver outcomes 2021, Diabetes Obes Metab, DOI: 10.1111/dom.14569
43. P Harrison: Weight Loss Surgery ‘Best Treatment’ for Fatty Liver Disease 2021, Medscape, https://www.medscape.com/viewarticle/963529
44. F Salomone, W Currenti et al: Effects of Intragastric Balloon in Patients With Non-alcoholic FattyLiver Disease and Advanced Fibrosis 2021, Liver International 41(9):2112-2116, https://www.medscape.com/viewarticle/957258
45. K A Seeberg, H Borgeraas et al: Gastric Bypass Versus Sleeve Gastrectomy in Type 2 Diabetes: Effects on Hepatic Steatosis and Fibrosis, 2022, Annals of Internal Medicine, https://doi.org/10.7326/M21-1962
46. R E Soccio: Galectin-3 in NAFLD: Therapeutic Target or Noncausal Biomarker? 2021, JCEM, 106(9):e3773-e3774, doi:10.1210/clinem/dgab363
47. J V Lazarus, Q M Anstee et al: Defining comprehensive models of care for NAFLD 2021, Nature Review Gastroenterology & Hepatology, https://doi.org/10.1038/s41575-021-00477-7
48. S Niezen, M Mehta et al: Coffee Consumption Is Associated With Lower Liver Stiffness: A Nationally RepresentativeStudy 2021, Clinical Gastroenterology and Hepatology, https://doi.org/10.1016/j.cgh.2021.09.042
49. Z Hamza: A Cup of Joe to Thwart Liver Fibrosis? How About Four — Study finds protective benefit with high consumption, though not for fatty liverdisease 2021, MedPage Today, https://www.medpagetoday.com/gastroenterology/generalhepatology/94940?xid=nl_mpt_DHE_2021-10-09&eun=g1487684d0r&utm_source=Sailt%E2%80%A6
50. L Valenti: Food Concerns Linked to Liver Disease 2021, Gastroenterology & Endoscopy News 2021, https://www.gastroendonews.com/Article/PrintArticle?articleID=64810
51. X Wang, S Lin et al: Higher plain water intake is related to lower newly diagnosed nonalcoholic fatty liver disease risk: a population-based study 2021, European Journal of Clinical Nutrition, https://doi.org/10.1038/s41430-021-00891-9
52. A nem alkoholos zsírmáj kockázatának felbecslése 2022, Medical Online,
http://medicalonline.hu/gyogyitas/cikk/a_nem_alkoholos_zsirmaj_kockazatanak_felbecslese
53. J V Lazarus, H E Mark et al: Advancing the global public health agenda for NAFLD: a consensus statement 2022,Nature Reviews Gastroenterology & Hepatology, 19:60-78, https://doi.org/10.1038/s41575-021-00523-4
54. X Hu, W Yu et al.: First-degree family history of diabetes is associated with nonalcoholic fatty liver diseaseindependent of glucose metabolic status 2021, Journal of Diabetes and Its Complications, 36(1), https://doi.org/10.1016/j.jdiacomp.2021.108083
55. L Bosembiante, G Targher, C Maffeis: Non-alcoholic fatty liver disease in obese children and adolescents: a role for nutrition? 2022, European Journal of Clinical Nutrition, 46:28-39, https://doi.org/10.1038/s41430-021-00928-z
56. A Mantovani, C D Byrne, G Targher: Efficacy of peroxisome proliferator-activated receptor agonists, glucagon-like peptide-1 receptor agonists, or sodium-glucose cotransporter-2 inhibitors for treatment of non-alcoholic fatty liver disease: a systematic review 2022, Lancet Gastroenterology & Hepatology, https://doi.org/10.1016/S2468-1253(21)00261-2
57. M M Ruissen, A L Mak et al: Non-alcoholic fatty liver disease: a multidisciplinary approach towards a cardiometabolic liver disease 2020, European Journal of Endocrinology, 183:R57-R73, https://eje.bioscientifica.com/view/journals/eje/183/3/EJE-20-0065.xml
58. R M Pontes-da-Silva, T de Souza Marinho et al: Obese mice weight loss role on nonalcoholic fatty liver disease and endoplasmic reticulum stress treated by a GLP-1 receptor agonist 2021, International Journal of Obesity, https://doi.org/10.1038/s41366-021-00955-7
59. M Deng, F Qu et al: SCFAs alleviated steatosis and inflammation in mice with NASH induced by MCD 2020, Journal of Endocrinology, 245:425-437, https://doi.org/10.1530/JOE-20-0018
60. G E Chung, E J Chou et al: Young adults with nonalcoholic fatty liver disease, defined using the fatty liver index, can be at increased risk of myocardial infarction or stroke 2021, Diabetes Obes Metab, DOI: 10.1111/dom.14597
61. N Chalasani, Z Younossi et al: The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases 2018, Hepatology, 67(1):328-357, doi: 10.1002/hep.29367
Függelék: E vitamin, LiverLuv
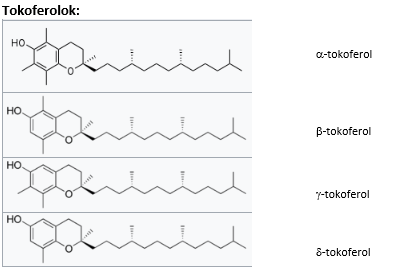
E vitamin
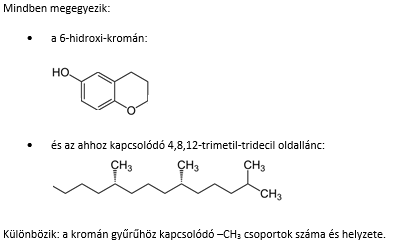
Az E vitamin valójában több vegyület keveréke. Ezek: a tokoferolok (α,β,γ,δ) és a tokotrienolok (α, β, γ, δ). A tokoferol név az ógörög τοκοσ (szülés) és Φερειν (hordás) („terhesség védő”) szavakból tevődik össze, míg az –ol végződés a molekulában lévő
–OH csoportra utal.
Az E-vitamin (tokoferolok/tokotrienolok keveréke) zsírban oldódó vitamin, mely hatásos szabadgyök semlegesítő (antioxidáns). A javasolt napi étrendi bevitel (recommended dietary allowance, RDA) 15 mg (α-tokoferolra számítva). Ez másképpen 22,5 IU (mivel 1 mg=1,5 IU). Mivel zsírban oldódó vitamin, a napi maximálisan bevihető mennyiség korlátozott. Az Európai Élelmiszerbiztonsági Ügynökség (European Food Safety Authority, EFSA) a napi maximális, α-tokoferolra számolt bevitelt 300 mg-ban (450 IU-ban) állapította meg. Az étrendi E-vitamin forrást elsősorban az olajos magvakból sajtolt növényi olajok jelentik.
Az E-vitamin hiány ritka, ha kialakul, ideg ingerületvezetési, ideg-izom ingerületátvezetési problémák, spinocerebellaris ataxia, izombántalmak alakulhatnak ki. Mivel a vitamin antioxidáns, hiányában a vörösvértestek oxidatív károsodása miatti anémia is előfordulhat. Hiányában nagyobb valószínűséggel alakul ki Alzheimer kór vagy vaszkuláris demencia. A daganatképződés, a katarakta, a szív-érrendszeri betegségek megelőzésére gyakorolt hatását nem tudták egyértelműen bizonyítani. Ugyanígy nincs egyértelmű bizonyíték a szülészeti kockázati tényezőket (koraszülés, preeklampszia, újszülötthalálozás) kivédő hatására sem.
A nagy dózisban adott E-vitamin az aszpirin és a warfarin hatását potenciálja, a tamoxifen és a cyclosporin A szérum szintjét csökkenti. A nagy dózis fokozza a vérzékenység veszélyét és a szív-érrendszeri események kockázatát61.
LiverLuv
Honlap: https://luvbynature.com/liver-luv/?AFFID=402363
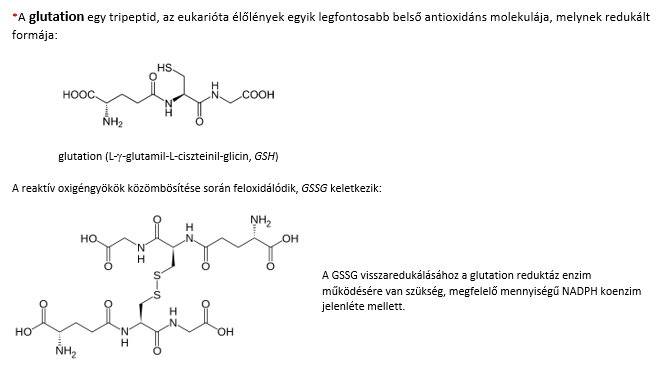
Több amerikai hepatológus javasolja ezt a májvédő, antioxidáns, főként gyógynövény kivonatokból (glutation* szupplementumokból) álló készítményt (étrendkiegészítőt). A hatóanyagok foszfatidilkolin tartalmú liposzómába csomagoltak, ezzel biztosítják azok sejtmembránon történő átjutását és lehetővé teszik, hogy az így bejuttatott molekulák a sejten belül fejtsék ki hatásukat.
Összetétele:
1. Máriatövis kivonat (májvédő, méregtelenítő, antioxidáns)
A növény fő alkaloidja a szilimarin (silymarin), több flavonolignánból álló keverék, melynek legfontosabb komponensei:
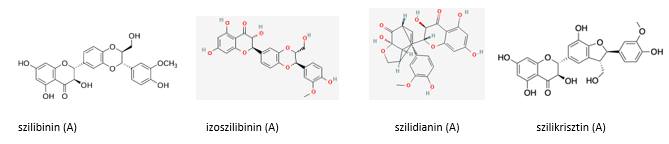



5. Szelén
Daganatellenes, szívizomvédő hatású nyomelem. Több, fontos enzim pl. az antioxidáns feladattal rendelkező, a szubcelluláris membránok integritásában fontos szerepet játszó glutation peroxidáz, a glutation redukált formájának visszaállításához szükséges tioredoxin reduktáz, a pajzsmirigyhormonok metabolizmusához szükséges dejodinázok alkotóeleme.
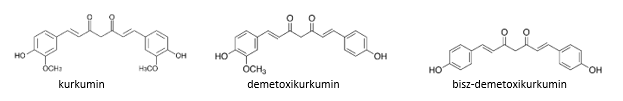
6. Kurkuma kivonat
A növény fő hatóanyagai, a kurkuminoidok szintén antioxidánsok, a szuperoxid gyököket hatásosan semlegesíteni képes vegyületek, melyek ciklodextrinnel képzett komplex formájában vannak jelen a növényben.