szerző: Dr. Krkos Károly
Az előző században az autoimmun betegségek gyakorisága meghaladta a fertőzőbetegségekét a fejlett országokban. Ezen multifaktoriális betegségek kialakulásában genetikai, környezeti tényezők, a mikrobiom állapota játszik szerepet. Az autoimmun kórképek jelenleg rendelkezésre álló kezelései az immunrendszer gyengítésén alapulnak és fokozzák a rosszindulatú daganatok és a fertőzések kialakulásának kockázatát. Az utóbbi évtizedekben egyértelművé vált, hogy ezek az állapotok eltérő, „diszbiótikus” mikrobiom kialakulásával jellemezhetők, továbbá hogy a gyulladásos bélbetegségekben (IBD-ben) vagy rheumatoid arthritisben szenvedő betegek kezelésének hatékonyságát a bél mikrobiom összetétele, a használt gyógyszer metabolizmusa is befolyásolja. A mikrobiom közvetlenül vagy az étrendi metabolitok átalakításával módosítja az innate és az adaptív immunitást, így a mikrobiom összetételének és aktivitásának változtatása hozzájárulhat az autoimmun betegségek megelőzéséhez és kezeléséhez.
Ábra (1): Az étrend és mikrobiom egymásra hatása és a gazdaszervezet egészsége (32. irodalmi utalás alapján)
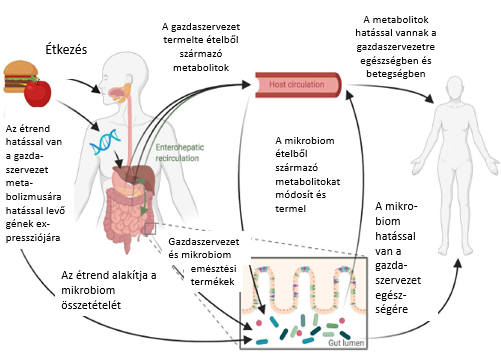

Az étrendi mintázatokban meglévő nagy különbségek ellenére, a hús- és a feldolgozott ételfogyasztás körülményei között élő ember mikrobiomja jelentős változáson ment keresztül, ilyen a mikrobiális szénhidrát-aktív enzimek (Carbohydrate Active enZymes – CAZymes) bőségének kialakulása6,7. A CAZymes jelentős szerepet játszanak a szénhidrátok lebontásában, a glüko-konjugátumok, oligoszacharidok és poliszacharidok szintézisének módosulásában. Ezeket a folyamatokat az étrendváltozásokon kívül egyéb tényezők is befolyásolták (pl. antibiotikumok megjelenése a betegségek kezelésében). Annak felismerése, hogy az étrendváltozások jelentősen hozzájárultak az autoimmun betegségek gyakoriságának növekedéséhez, speciális diétás protokoll (autoimmun protokoll, AIP) kidolgozásához vezetett, melynek lényege, hogy a bél gyulladásos folyamatait esetleg kiváltani képes ételeket kizárják az étrendből. A nyugati típusú táplálkozás nem támogatja a diverz, rugalmas mikrobiota kialakulását. A higiénia hipotézis szerint az élet korai szakaszában a hiper-higiénikus környezet nem segíti a normális immuntolerancia kifejlődését. Az újabb irodalmi adatok alátámasztják, hogy az autoimmun betegségek megjelenésekor a bélrendszer barrier-funkciója károsodik és így az atipikus külső antigének bejutása és érzékelése immundiszregulációhoz vezet2,3,4,5.
A bél mikrobiom és a gazdatest immunitás
Az élet korai szakaszában a mikrobiota kolonizáció és a gazdaszervezet immunrendszerének kölcsönhatása proinflammatórikus vagy antiinflammatórikus túlsúlyt indukál, mely az egész életre kihat. A császármetszés, nem anyatejes táplálás, antibiotikus használat megzavarhatja ezeket a folyamatokat. Az anyatejben lévő oligoszacharidok elősegítik a Bifidobacterium fajok kolonizációját, melyek a korai mikrobiota túlsúlyban lévő összetevőjévé válnak és fukózt, acetátot, piruvátot és 1,2-propándiolt termelnek elősegítve ezzel a mikrobiota expanziót és segítve a kommenzális flóra iránti tolerancia kialakulását8,9. A szilárd táplálék bevezetése után (6 hónapos kor körül) a baktériumközösség jelentősen megváltozik, nagymennyiségű különböző metabolitot termelve (pl. butirátot, mely elősegíti a vastagbél nyálkahártya érését10 és gátolja a nagy patogén potenciállal rendelkező baktériumok növekedését11). A mikroba antigén okozta nem megfelelő TLR stimuláció hatással lehet autoimmun betegség progressziójára (SLE egérmodellben TLR7 overexpresszió figyelhető meg11). Ebben a kísérletben a lupus progresszióját csökkenteni lehetett rezisztens keményítő etetésével, megváltoztatva ezzel a mikrobiális flóra és metabolitok összetételét11. Sclerosis multiplex állatkísérletes vizsgálata során a TLR2 receptort bakteriális lipoproteinekkel stimulálva, csökkent a betegség súlyossága12. Ezek az eredmények azt támasztják alá, hogy a bél mikroorganizmusokra jellemző molekuláris mintázat a TLR szignál fontos regulátora, mely hozzájárul a tolerogén bélkörnyezethez12.
Az autoimmun betegségek keletkezését, melynek alapja a mikrobiom mintázat megváltozása és a bél barrier funkciójának működészavara, állatmodelleken végzett tanulmányok bizonyították2,13,14. Az étrendváltozások hatással vannak a mikrobiom összetételére és metabolit termelésére. A bél mikrobák közvetlenül (mikroba asszociált molekuláris mintázatok – MAMPs és patogén asszociált molekuláris mintázatok – PAMPs révén) vagy indirekt módon (metabolit termelés változása útján) hatnak az innate és az adaptív immunitásra. A megsérült nyákréteg vagy a meggyengült tight junction miatt károsodott bél barrier hozzájárul az antigén prezentáló sejtek (dendritikus sejtek, makrofágok) atipikus antigéndetektálásához. A toll-like receptor (TLR) toleranciát módosítani képes bél mikrobiom15 is szerepet játszhat az autoimmun betegségek súlyosbításában, mivel a kommenzális baktériumok által kiváltott inadekvát TLR aktiváció magzavarhatja az immunregulációt16,17. Az autoimmun betegekben a CD4+ T-sejt populáció a betegséget aktiváló Th1 és Th17 irányba tolódik, míg a regulátoros T sejtek (Treg) aránya csökken. Mindez hatással van a mikroba metabolitok (mint butirát18 vagy propionát19) keletkezésére.
Autoimmun betegekben mikrobiom kiváltotta adaptív immun diszreguláció figyelhető meg. Sclerosis multiplexben szenvedő betegek mikrobiomjában nagyobb arányban található Akkermansia muciniphila és Acinetobacter calcoaceticus, melyek szerepe bizonytalan a bél homeosztázisban, in vitro a Th1 differenciálódást stimulálják, de a Treg irányba differenciálódást nem17. Az emlős bél kommenzális flórája, főként a Clostridium IV és XIVa klaszterek, melyek az élelmiszerrostokat butiráttá képesek bontani, a Treg fejlődést indukálják, egér modellben mennyiségük fordítottan arányos a colitis súlyosságával18. Jellegzetes, hogy autoimmun betegségekben Treg/effektor T arány eltolódik a homeosztatikus szinthez képest: csökken a tolerogén, IL-10 termelő CD25+FOXP3+ T (Treg) sejtek száma az effektor Th1 és Th17 sejtekhez képest20. Ezek a változások hozzájárulhatnak a bél áteresztőképességének növekedéséhez a keletkező pro-inflammatorikus citokinek (TNFa, IL-17) miatt, mivel ezek módosítják a tight junction fehérjéit – ezt egér modellben21,24 és sclerosis multiplexben szenvedő betegekben22,23 bizonyították.
Az étrend és a mikrobiom
Az étrendváltoztatás módosítani képes a mikrobiom és az általa termelt metabolitok összetételét25-28. A Bacteroides törzsek jelentős növekedése a Prevotellához képest a rostbontó enzimek génjeinek csökkenésével jár29.
Étrendi szénhidrát fermentáció témában számos randomizált, kontrolált vizsgálat történt, melyekben a rostbevitel mikrobiom-összetételre vagy aktivitásra gyakorolt hatását értékelték. A mikrobiom-változások egyének szerint különbözőek, viszont egy kiválasztott roststruktúrára adott válasz meglepően ellentmondásmentes34. Például a kukorica rezisztens keményítőjét (resistant starch – RS4) vizsgálva dózis-válasz tanulmányban az Eubacterium rectale megszaporodását észlelték, míg a tápióka RS4 a Parabacteroides distasonis növekedését idézte elő33.
Prebiotikumok és posztbiotikumok definíciójuk szerint (International Scientific Association for Probiotics and Prebiotics) szelektíven a gazda mikroorganizmusok által használt szubsztrátok, melyek jótékony hatásúak az egészségre35. Egy magas rost-tartalmú diétát vizsgáló (17 hétig tartó prospektív, randomizált) tanulmányban a résztvevők CAZyme profiljának megváltozását figyelték meg, az SCFA termelődés változása nélkül36. A bevitt rost mennyisége a széklet szénhidrát tartalmával mutatott korrelációt, ami arra utal, hogy a mikrobiota nem volt képes teljesen lebontani a rostot, mivel a rostbontó út telítődött. A rostbevitel növelése közvetlenül nem jelenti az SCFA szintézis fokozódását, az a mikrobiota állapotától is függ. Egy colitis ulcerosa betegségben szenvedők csoportját elemző tanulmányban azt találták, hogy az érintettekben a fő butirát termelő baktériumok – Roseburia hominis és Faecalibacterium prauznitzii – mennyisége csökkent az egészségesekéhez képest és a csökkenés mértéke a betegség aktivitásával párhuzamosan változott37,38. Ezek alapján elmondható, hogy a bakteriális SCFA termelés mértéke jobb mutató, mint a bevitt rost mennyisége. Az SCFA termelés szükséges az immun-homeosztázishoz és a bél egészséges barrier funkciójához39. Ez irányította a figyelmet a mikroorganizmusok által termelt metabolitok, a posztbiotikumok gazdaszervezet egészségét jótékonyan befolyásoló hatására. Állatkísérletben és humán vizsgálatban igazolódott, hogy a nem megfelelő butirát képződés hatására a nyáktermelő kehelysejtekben a b-oxidációt anaerob glikolízis váltja fel, mely negatívan hat a kehelysejtek differenciálódására és MUC2 (a nyák fő glikoprotein komponense) termelődésére40. Ezzel fokozódik a mikróbák oxigén kitettsége41, mely kedvezőtlenül hat a fő butirát termelő anaerobokra42. A butirát egy másik jótékony hatása, hogy downregulálja a proinflammatorikus citokinek transzkripcióját, és elősegíti a Th-sejtek Treg sejtekké differenciálódását39,43. A másik fő SCFA, a propionát fontos szerepet játszik a májban folyó glükoneogenezisben, a jólakottság érzés kialakulásában és a koleszterin csökkenésében44. Egy sclerosis multiplexes betegcsoportban a rutin kezelést propionát adással kiegészítve remissziót értek el és a Treg sejtek száma nőtt a Th1 és Th17 sejtek számának csökkenése mellett45.
Exkluzív vagy eliminációs diéta az SCFA termelés optimalizálását célozza. IBD betegek esetén ez nem egyszerű, mivel a páciensek rost fogyasztása után puffadásról, túlzott gázképződésről panaszkodnak46. Bár összetett szénhidrátok adása nem javasolt a betegség aktiív fázisa alatt vagy sebészeti beavatkozás után, de remisszió alatt szerepet játszhat a diétában. IBD betegeknek exkluzív (EEN) vagy részleges enterális táplálást (PEN) javasolnak. Előbbi esetén ez lehet elementáris (aminosavakat tartalmazó), szemi-elementáris (oligopeptideket tartalmazó) vagy polimer (teljes fehérjéket tartalmazó) folyékony étrend. PEN esetén a folyékony táplálékot szilárd étellel egészítik ki, melynek alapja a CDED – a Crohn betegek exklúziós étrendje. Ennek lényege, hogy energia- és fehérjegazdag, zsírszegény, durvarost-mentes, tejmentes, továbbá az egyszerű cukrokat nélkülözi. A CDED csökkenti a Proteobacteriumok mennyiségét és a gyulladást. Az EEN segíti a Crohn betegek remisszióját, megváltoztatja a vastagbél-mikrobiota metabolit-termelését: a fehérje fermentáció dominál a szénhidrát erjesztéssel szemben47. Nem egyértelmű, hogy mi az a tényező, ami a remissziót valójában kiváltja: a rosthiány, egyéb étrendi komponens hiánya, a baktériumok diverzitásának és sűrűségének csökkenése vagy mindezek kombinációja1.
fehérjék emésztésük során a gazdaszervezet enzimjei segítségével aminosavakra, kisebb peptidekre bomlanak, melyek zöme a vékonybélből felszívódik. A peptidek egy része elérheti a vastagbelet, ahol a mikrobák alakítják át. Kísérletes adatok alapján ezeknek 17-38%-ából rövid szénláncú zsírsav (SCFA) képződik. A fehérjedegradáció során a kommenzális flóra esszenciális aminosavakat és elágazó láncú zsírsavakat (BCFA) is képez, melyek a clonocyták alternatív energiaforrásaként működnek49. Emellett toxikus anyagok is keletkeznek: ammónia, kénhidrogén, fenolok, melyekről állatkísérletben (egér) bebizonyult, hogy fokozzák a bél áteresztőképességét48. IBD egérmodellben állati eredetű fehérjékkel történt táplálás a colitis fellángolását, proinflammatorikus makrofágok aktiválódását okozták, ugyanakkor növényi fehérjék ilyen folyamatokat nem váltottak ki50. A különböző fehérjék – leszámítva, hogy minden aminosav deaminálódik ammóniaképzés közben – biokémiai jellegzetességeiktől függően másként befolyásolják a baktériumokat:
- BCFA (elágazó szénláncú zsírsav) csak az elágazó láncú aminosavakból keletkezik51;
- a szulfatált aminosavak a szulfát-redukáló, kénhidrogén képző baktériumoknak kedveznek, azok expanzióját okozzák, mint ahogy az colitis ulcerosában szenvedő betegekben ez megfigyelhető volt52;
- az aromás aminosavakat főként az Enterobacter és Escherichia fajok kedvelik, azokból fenolokat képeznek;
- az egyik esszenciális aminosav, a triptofán mikrobák általi metabolizációja során (indol-út) keletkező termékek a gazdaszervezet aril-szénhidrogén receptoraihoz kötődve csökkentik a proinflammatorikus citokinek és kemokinek expresszióját és elősegítik az IL-22 termelődését, mely antimikrobiális peptidek felszabadítására késztetik az epithelium sejteket és szabályozzák a mikrobiota növekedését53,54;
- triptofán bevitel vagy triptofán termelő Lactobacillus törzsek enyhítették a colitis egérkísérletben53-55.
Az étrendi zsír metabolizmusának hatása amellett, hogy táplálékforrást jelent a bélmikrobák számára, az epesavtermelés fokozásán keresztül hat a mikrobiota összetételére56,57, elősegíti a nagy patogén potenciállal rendelkező kommenzális baktériumok58 (pl. Bilophila wadsworthia) szaporodását. A mikrobiota összetételének megváltozása zsírbevitel hatására, a mikrobák termelte másodlagos epesavak mennyiségét módosíthatja. A magas zsír-tartalmú étel a lipopoliszacharidok (LPS) növekedésével, a proinflammatorikus TLR4 útvonal indukálásával jár, s ez alacsony szintű gyulladáshoz vezet, mely alapvető hatással van az autoimmun aktivitásra60,61. Hasonlóan LPS forrást és proinflammatorikus hatást jelent a Gram-negatív baktériumok megszaporodása60, melyet az LPS-okozta gyulladást csökkenteni képes Bifidobacterium fajok tudnának ellensúlyozni – így ezek megkevesbedése is a proinflammatorikus folyamatoknak kedvez60. Ugyanakkor telítetlen zsírsavakban gazdag étel (pl. dió) fogyasztása a Faecalibacterium, Roseburia és Clostridium törzseket gazdagítja, melyek csökkentik a mikrobáktól származó proinflammatorikus hatású másodlagos epesavak termelődését59.
Az ételfeldolgozás a következőket foglalja magába: hő (pl. főzés), mechanikus hatás (pl. szeletelés, darálás, felverés), adalék anyagok használata, a tartósság és az emészthetőség fokozásáért, az étel ízének és megjelenésének javításáért. A keményítőben gazdag nyers gumók fogyasztása csökkenti a baktériumok mennyiségét, fokozza a mikrobiom metabolizmust, ha azt összehasonlítjuk főtt gumókat fogyasztó egyének mikrobiotájáva62. A mikrobiális metabolizmus a gazdaszervezetre nézve lehet jótékony vagy toxikus, továbbá módosíthatja a gyógyszerek hatását63. A teljes kiőrlésű búzaliszt főzési-fagyasztási ciklusokkal történő kezelése jelentősen megnöveli a rezisztens keményítő arányát, melynek in vitro fermentálódása során emelkedik a propionát-szint és a Bifidobacteriumok száma64. Az adalékanyagok használatának egyre gyakoribbá válásával megszaporodtak az autoimmun betegségek, melyben a tight junction integritásának károsodása és a bél-permeabilitás fokozódása játszhat szerepet65. A különböző (exklúziós, eliminációs) diéták alkalmazásánál általános elv az élelmiszeripari termékek, adalékokat tartalmazó ételek kivonása az étrendből.
A mikrobiota módosításának lehetőségei
A különböző autoimmun betegségekben szenvedő páciensekben a mikrobiális diverzitás alacsony67, a diverzitás gazdagítása előnyt jelent a mikrobiota és így a beteg számára66. Azonban nem lehet azt állítani, hogy a nagyon diverz mikrobiom azonos az egészséges mikrobiommal. A machine learning a hatásos eszköze annak, hogy a meglévő metagenomikus és metabolomikus adatokat kiaknázva jobban megismerhessük az autoimmun betegségek és a mikrobiom összefüggéseit68.
(Machine learning: komputereket használó módszer, melynek során a gépeknek megtanítják, hogyan használják az adatokat hatékonyabban. A gépek képessé válnak tanulni, közvetlen programozás nélkül70.)
A gazdaszervezet genetikai tényezői, meglévő mikrobiotájának állapota (egyéb tényezők mellett) befolyásolhatja, hogy a páciens hogyan reagál az étrendváltoztatásra26,69,71-73. Egyre több ismeret gyűlik össze a diéta segítségével történő bél mikrobaösszetétel személyre szabott megváltoztatásával kapcsolatban.
Az optimális beavatkozáshoz figyelembe kell venni a betegség állapotát, a betegségre jellemző biomarkereket, a bél mikrobiom összetételét és működését valamint a beállított gyógyszeres kezelést. A terápiás diétát személyre szabottan kell megállapítani, megelőzően prediktív modellezés szükséges: humán randomizált, kontrollált vizsgálatok, cross-over étrendi beavatkozások szükségesek ahhoz, hogy biztosítsák a betegség remisszióját, továbbá az állat kísérletes vizsgálatok eredményét humán tanulmányokban kell értékelni, majd az itt szerzett tapasztalatokat vissza kell fordítani a kísérleti munkába. [Pl. humán mikrobiom-asszociált (HMA) rágcsáló modellt beteg és kontrol mintákkal kolonizálnak és ezeket az állatokat vizsgálják különböző összetevőjű diéta alkalmazása mellett.]1
A bél mikrobiota befolyásolása
Számos lehetőség kínálkozik a bél mikroba rendszerének manipulálására, mely az egészséges mikrobiota helyreállítását célozza. Ezek a technikák:
- a széklet mikrobiom transzplantáció (FMT) és ennek kombinálása speciális diétákkal vagy étrendkiegészítőkkel;
- az ortogonális niche engineering.
FMT és diéta együttes alkalmazása hatásosan javíthatja a beteg állapotát, bár működésének mechanizmusa még nem teljesen feltárt. Az eljárást először rekurráló gasztrointesztinális Clostridioides difficile infekció (CDI) kezelésére alkalmazták, sikeresen: a módszerrel betegek mintegy 90%-a tünetmentessé vált75. Az FMT kezelés hatását számos egyéb betegségben is elkezdték tanulmányozni: T1DM76, sclerosis multiplex77, cöliákia78, rheumatoid arthritis79– ezekkel kapcsolatban egyenlőre kevés adat áll rendelkezésre. A colitis ulcerosa80-83, Crohn betegség84-85, májbetegségek86,87, metabolikus szindróma88, kóros neurológiai folyamatok89 jobban vizsgált állapotok, de a kezelés hatásossága ezekben az állapotokban nem közelítette meg a CDI kezelésének sikerét. Az a hipotézis, hogy bizonyos mikrobiota összetétel kiválthatja a betegséget vagy ronthat a páciens állapotán (pl. az IBD bizonyos alcsoportjaiban90), mégis érvényesnek mondható, annak ellenére, hogy a nem tökéletes eredmények bizonyos csapdák és okok miatt jól dokumentáltak91-93. Bár nem alaposan kutatottak, de két megközelítést figyelemre méltónak tartanak:
- a recipiens étrendjét hasonlóvá teszik a donoréhoz, hogy a donor mikrobiota hatása biztosabb legyen az új gazdaszervezetben vagy
- az egészséges donor mikrobiota jótékony hatású komponenseit próbálják meg erősíteni CDED diétával vagy inulin-típusú fruktánok adagolásával, mely támogatja az SCFA termelő Roseburia és Faecalibacterium fajok felszaporodását74,96.
Az FMT önmagában csak részlegesen eredményes a tünetek enyhítésében94 vagy a remisszió indukálásában80. Emfizémás egereken vizsgálva, az FMT rostdús diétával kiegészítve kedvező hatással volt a mikrobiota összetételre és az SCFA termelésre95. Azokban az esetekben, mikor a donor mikrobiota összetétele nem ismert az FMT-t támogató diéta tervezése behatárolt. Egészséges donor székletéből származó jól-definiált kultúra használatára kellene törekedni97,98.
Probiotikum – diéta kombináció és a szinbiotikumok az FMT-től független lehetőség, ha egy vagy több (pl. VSL#399) mikroba- törzset adnak, mint probiotikumot. Ez gyakran alkalmazott terápiás lehetőség IBD páciensek kezelésére98,100,101. A mátrix, amiben a probiotikumot bejuttatják lehet étel (pl. joghurt, gabonaszelet), lehet protektív emulziót vagy biopolimert tartalmazó kapszula. A bevitt baktériumok életképességének megőrzése szempontjából fontos, hogy melyik formát választjuk, hiszen a választott mikrobák érzékenyek lehetnek a pH változásra (pl. a gyomor erősen savas környezete), a nem megfelelő oxigén tartalomra (a kommenzális flórában sok az obligát anaerob). A sikeres kolonizációhoz a mikrobák megfelelő védelme mellett fontos az is, hogy megfelelő tápanyaghoz jussanak102.
A prebiotikumokat és probiotikumokat kombinálhatják, ezek a szinbiotikumok. A komplementer szimbiotikumok jótékony hatású, de egymástól független prebiotikum – probiotikum keverékből állnak, a szinergista szinbiotikumokban lévő prebiotikum a probiotikum működését segíti, javítja annak túlélési esélyét és beépülését a gazdaszervezet mikrobiotájába30. A szinbiotikumok tanulmányozása emberben csak most kezdődött, de bizonyos kombinációkat hatásosnak találtak autoimmun betegek kezelésében. Bifidobacteriumok és Lactobacillusok kombinálása útifű maghéjjal104, frukto-oligoszacharidokkal105 és inulinnal106,107 kedvező hatásúnak bizonyult IBD betegekben. Hasonlóképpen rheumatoid arthritisben a Lactobacillus acidophilus, Lactobacillus casei és Bifidobacterium bifidum inulinnal kiegészített keveréke108, továbbá 1. típusú diabéteszben a Lactobacillus sporogenes maltodextrinnel és frukto-oligoszacharidokkal kombinálva109 mutatott jótékony hatást.
Az ortogonális niche engineering a szinbiotikum-koncepció továbbfejlesztése abban, hogy a mikroorganizmus-szubsztrátum kapcsolatot használja ki a baktériumok gazdaszervezet mikrobiotájába történő beépítéséhez110,111.
[Niche (ökológiai fülke): olyan tényezők együttese, avagy kölcsönhatása, aminek köszönhetően bizonyos fajok és populációk életben tudnak maradni, azaz nem pusztulnak el és nem kerülnek a kihalás veszélyébe112.]
Míg általában a szinbiotikumokban lévő prebiotikumok mindennapi tápanyagok, az ortogonális niche engineering során nem, vagy ritkán alkalmazott összetevőket használnak prebiotikumként a feladat ellátására. Pl. egy tengeri algából (Porphyra nemzetség) származó szulfatált poliszacharidot, a porfiránt alkalmazzák humán kommenzális mikrobiota egérbélbe történő betelepítésére110,111. Az emberi mikrobiom azon képessége, hogy a tengeri algát bontani tudja, elterjedtebb, mint eredetileg feltételezték. Az ortogonális niche engineering lehetővé teszi, hogy a bevitt baktériumok életképesek maradjanak a bél mikrobiomban és génjeik hasznosíthatók legyenek113. Az olyan folyamatok, mint az agaróz, a porfirán és a karragén lebontása, felhasználhatók jótékony hatású baktériumok betelepítésére, melyek vagy vad típusúak, vagy egy eredeti törzs módosított változatai, vagy az ortogonális tápanyagot felhasználni képes génekkel transzfektálták azokat. A módszer lehetőséget ad az indusztrializáció során elvesztett baktériumok visszavezetésére az emberi bélflórába. Ilyen például a Lactobacillus reiteri, melynek SLE-ben és sclerosis multiplexben kifejtett immunmodulátoros hatását részletesen vizsgálták egérkísérletekben114,115. Egy másik irány olyan rekombináns baktériumok létrehozása, melyek terápiás hatású vegyületeket termelnek. Például: Streptococcus thermophilus és Lactococcus lactis törzseket IL10 génnel transzfektáltak IBD állatok kezeléséhez116, továbbá Lactococcus lactis törzs DNS-ébe a humán defenzin-5 génjét vitték be, mely az NF-kB útvonal blokkolásával enyhítette a kísérleti állatok dextrán-szulfáttal kiváltott colitisét117.
A szokatlan nutriensek lehetővé teszik, hogy a kolonizáció mértéke és tartama egyénhez szabottan történjen. A hosszantartó folytonos, specializált tápanyagbevitel azonban az implantált baktériumok aktivitásának csökkenéséhez vezethet110. További probléma lehet, hogy a speciális tulajdonság (a gén, amivel a bevitt baktériumot transzfektálták), átjut más baktériumokra is horizontális géntranszfer útján103 és ez a specificitás csökkenéséhez vagy teljesen megváltozott válaszhoz vezethet.
Epidemiológiai vizsgálatok meta-analízise szerint a nagyobb rostbevitel (25-29g/nap) a nem-fertőző betegségek (pl. szív koszorúér betegségek, stroke, 2. típusú cukorbetegség, vastagbélrák) előfordulásának jelentős csökkenéséhez vezetne. Bár ígéretes adatok mutatják az étrendváltoztatás és a mikrobiom állapotának jelentőségét autoimmun betegségekben, ezek hatásmechanizmusa nem minden ponton ismert. Pl. azok a személyek, akiknek bélflórájában nagyobb arányban található Prevotella copri a Bacteroides fajok rovására, hajlamosabbak rheumatoid arthritis (RA) kifejlődésére31,118. Az RA betegek tüneteinek súlyossága különböző (vegán, glutén-mentes) diétával enyhíthető119. Ez az összefüggés bizonytalan120, annak ellenére, hogy számos tanulmány a mikrobiom- és étrendváltoztatás hatásossága mellett szól121.
Több kihívással kell még megküzdeni a mikrobiom-manipuláció területén. A humán mikrobiota rugalmassága miatt az állatkísérletek eredményei a humán vizsgálatok során nem adják azt a kifejezett változást, amit a kísérletek eredményei mutattak122. Bár az étrendváltoztatás a bélflóra megváltoztatásának hatásos eszköze lehet, de a diéta felfüggesztése a mikrobiota előző állapotába való visszatéréséhez vezethet123. Számos további vizsgálat és meggyőző eredmény szükséges ahhoz, hogy az egyénre szabott mikrobiota manipulálás a rutin kezelés részévé válhasson.
Irodalom
-
-
M Wolter, E T Grant et al.: Leveraging diet to engineer the gut microbiome 2021, Nature Reviews Gastroenterology and Hepatology, 18(12):885-902, DOI: https://doi.org/10.1038/s41575-021-00512-7
-
-
-
N J Wasko, F Nichols, R B Clark: Multiple sclerosis, the microbiome, TLR2, and the hygiene hypothesis 2020, Autoimmunity Reviews, 19(1):102430, https://doi.org/10.1016/j.autrev.2019.102430
-
-
-
W E Ruff, T M Greiling, M A Kriegel: Host-microbiota interactions in immune-mediated diseases 2020, Nature Reviews Microbiology, 18:521-538, https://doi.org/10.1038/s41579-020-0367-2
-
-
-
B Li, C Selmi et al.: The microbiome and autoimmunity: a paradigm from the gut-liver axis 2018, Cellular& Molecular Immunology, 15:595-609, https://doi.org/10.1038/cmi.2018.7
-
-
-
A Márquez et al.: Meta-analysis of immunochip data of four autoimmune diseases reveal novel single-disease and cross-phenotype associations 2018, Genome Medicine, 10:97, https://doi.org/10.1186/s13073-018-0604-8
-
-
-
A E Kaoutar, F Armougom et al: The abundance and variety of carbohydrate-active enzymes in human gut microbiota 2013, Nature Reviews Microbiology, 11:497-504, https://org/10.1038/nrmicro3050
-
-
-
S A Smits et al.: Seasonal cycling in the gut microbiome of the Hadza hunter-gatherers of Tanzania 2017, Science, 357:802-806, https://org/10.1126/science.aan4834
-
-
-
M A E Lawson et al: Breast milk-derived human milk oligosaccharides promote Bifidobacterium interactions within a single ecosystem. 2020, ISME J, 14:635-648, https://doi.org/10.1038/s41396-019-0553-2
-
-
-
S Fanning et al.: Bifidobacterial surface-exopolysaccharide facilitates commensal-host interaction through immune modulation and pathogen protection 2012, PNAS, 109:2108-2113
-
-
-
M Beaumont et al.: Gut microbiota derived metabolites contribute to intestinal barrier maturation at the suckling-to-weaning transition 2020, Gut, 11:1268-1286, https://doi.org/10.1080/19490976.2020.1747335
-
-
-
D F Zegarra-Ruiz et al.: A diet-sensitive commensal lactobacillus strain mediates TLR7-dependent systemic autoimmunity 2019, Cell Host & Microbe, 25:113-127.e6, https://doi.org/10.1016/j.chom.2018.11.009
-
-
-
M Fujiwara et al.: Enhanced TLR2 responses in multiple sclerosis 2018, Clinical Experimental Immunology, 193:313-326, https://doi.org/10.1111/cei.13150
-
-
-
D Zheng, T Liwinski, E Elinav: Interaction between microbiota and immunity in health and disease 2020, Cell Research, 30:492-506, https://doi.org/10.1038/s41422-020-0332-7
-
-
-
B Li, C Selmi et al.: The microbiome and autoimmunity: a paradigm from the gut-liver axis 2018, Cellular and Molecular Immunology, 15:595-609, https://doi.org/10.1038/cmi.2018.7
-
-
-
E D’Hennezel, S Abubucker et al.: Total lipopolysaccharide from the human gut microbiome silences toll-like receptor signaling 2017, mSystems, 2:e00046-17, https://doi.org/10.1128/mSystems.00046-17
-
-
-
D R Zegarra-Ruiz et al.: A diet-sensitive commensal Lactobacillus strain mediates TLR7-dependent systematic autoimmunity 2019, Cell Host & Microbe, 25:113-127.e6, https://10.1016/j.chom.2018.11.009
-
-
-
E Cekanaviciute et al.: Gut bacteria from multiple sclerosis patients modulate human T cells and exacerbate symptoms in mouse model 2017, PNAS, 114:10713-10718, https://doi.org/10.1073/pnas.1711235114
-
-
-
K Atarashi et al.: Induction of colonic regulatory T cells by indigenous Clostridium species 2011, Science, 331(6015):337-341, https://doi.org/10.1126/science.1198469
-
-
-
A Dusha et al.: Propionic acid shapes the multiple sclerosis course by an immunomodulatory mechanism 2020, Cell, 180:1067-1080.e16, https://doi.org/10.1016/j.cell.2020.02.035
-
-
-
N Ohkura, Y Yasumizu et al.: Regulatory T-cell specific epigenomic region variants are a key determinant of susceptibility to common autoimmune diseases 2020, Immunity, 52:1119-1132.e4, https://doi.org/10.1016/j.immuni.2020.04.006
-
-
-
J S Lee, C M Tato et al.: Interleukin-23-independent IL17 production regulates intestinal epithelial permeability 2015, Immunity, 43:727-738, https://doi.org/10.1016/j.immuni.2015.2015.09.003
-
-
-
I Cosorich, G Dalla-Costa et al.: High frequency of intestinal Th17 cells correlates with microbiota alterations and disease activity in multiple sclerosis 2017, Science Advances, 3:e1700492, https://doi.org/10.11266sciadv.1700492
-
-
-
M C Buscarinu, B Cerasoli et al.: Altered intestinal permeability in patients with remitting-relapsing multiple sclerosis: a pilot study 2017, Multiple Sclerosis Journal, 23:442-446, https://doi.org/10.1177/1352458516652498
-
-
-
X Zhang, B D Chen et al.: The gut microbiota: emerging evidence in autoimmune diseases 2020, Trends in Molecular Medicine, 26:862-873, https://doi.org/10.1016/j.molmed.2020.04.001
-
-
-
R N Carmodi, G K Gerber et al.: Diet dominates host genotype in shaping the murine gut microbiota 2015, Cell Host & Microbiome, 17:72-84, https://doi.org/10.1016/j.chom.2014.11.010
-
-
-
A Wenkataraman, J R Sieber et al.: Variable responses of human microbiomes to dietary supplementation with resistance starch 2016, Microbiome, 4:33, https://doi.org/10.1186/s40168-016-0178-x
-
-
-
G D Wu, C Compher et al.: Comparative metabolomics in vegans and omnivores reveal constraints on diet-dependent gut microbiota metabolite production 2016, Gut, 65-63-72, https://doi.org/10.1136/gutjnl-2014-308209
-
-
-
A M Sheflin, C L Melby et al.: Linking dietary patterns with gut microbial composition and function 2017, Gut Microbes, 8:113-129, https://doi.org/10.1080/19490976.2016.1270809
-
-
-
P Vangay, A J Johnson et al.: US immigration westernizes the human gut microbiome 2018, Cell, 175:962-972.e10, https://doi.org/1016/j.cell.2018.10.029
-
-
-
K S Swanson et al: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of synbiotics. 2020, Nature Reviews Gastroenterology and Hepatology, 17:687-701, https://doi.org/10.1038/s41575-020-0344-2
-
-
-
J C Clemente, J Manasson, J U Scher: The role of gut microbiome in systematic inflammatory disease 2018, BMJ, 360:j5145, https://doi.org/10.1136/bmj.j5145
-
-
-
A J Johnson, J J Zheng et al.: A guide to diet and microbiome study design 2020, Frontiers in Nutrition, 7:79. https://doi.org/10.3389/fnut.2020.00079
-
-
-
E C Deehan, C Yang et al.: Precision microbiome modulation with discrete dietary fiber structures directs short-chain fatty acid production 2020, Cell Host & Microbiome, 27:389-404.e6, https://doi.org/10.1016/j.chom.2020.01.006
-
-
-
D So, K Whelan et al.: Dietary fiber intervention on gut microbiota composition in healthy adults: a systematic review and meta-analysis 2018, American Journal of Clinical Nutrition, 107:965-983, https://doi.org/10.1093/ajcn/nqy041
-
-
-
G R Gibson, R Hutkins et al.: Expert consensus document: the International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics 2017, Nature Reviews Gastroenterology and Hepatology, 14:491-502, https://doi.org/10.1038/nrgastro.2017.75
-
-
-
H C Wastyk, G K Fragiadakis et al.: Gut microbiota-targeted diets modulate human immune status 2021, Cell, 184:4137-4153, https://doi.org/10.1016/j.cell.2021.06.019
-
-
-
K Machiels, M Joossens et al.: A decrease of the butyrate-producing species Roseburia hominis and Faecalibacterium prausnitzii defines dysbiosis in patients with ulcerative colitis 2014, Gut, 63:1275-1283, https://doi.org/10.1136/gutjnl-2013-304883
-
-
-
H Earley, G Lennon et al.: Colonization of the colonic mucus gel layer with butyrogenic and hydrogenotropic bacteria in health and ulcerative colitis 2021, Scientific Reports, 11:7262, https://doi.org/10.1038/s41598-021-86166-6
-
-
-
D P Venegas, M K De la Fuente et al.: Short chain fatty acids (SCFAs) mediated gut epithelial and immune regulation and its relevance for inflammatory bowel diseases 2019, Frontier in Immunology, 10:277, https://doi.org/10.3389/fimmu.2019.00277
-
-
-
A Sünderhauf, M Hicken et al.: Loss of mucosal p32/gC1qR/HABP1 triggers energy deficiency and impairs goblet cell differentiation in ulcerative colitis 2021, Cellular and Molecular Gastroenterology and Hepatology, 12:229-250, https://doi.org/10.1016/j.jcmgh.2021.01.017
-
-
-
M X Byndloss, E E Olsan et el.: Microbiota activated PPAR-g signaling inhibits dysbiotic Entrobacteriaceae expansion. 2017, Science, 357:570-575, https://doi.org/10.1126/science.aam9949
-
-
-
M Y Zheng, N Imohara and G Nuňez: Mechanisms of inflammation-driven bacterial dybiosis in the gut. 2017, Mucosal Immunology, 10:18-26, https://doi.org/10.1038/mi.2016.75
-
-
-
Y Furusawa et al.: Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T-cells. 2013, Nature, 504:446-450, https://doi.org/10.1038/nature12721
-
-
-
P Luis, HJ Flint: Formation of propionate and butyrate by the human colonic microbiota. 2017, Environmental Microbiology, 19:29-41, https://doi.org/10.1111/1462-2920.13589
-
-
-
A Duscha, B Gisevius et al.: Propionic acid shapes the multiple sclerosis disease course by an immunomodulatory mechanism. 2020, Cell, 180:1067-1080.e16, https://doi.org/10.1016/j.cell.2020.02.035
-
-
-
A B Cohen, D Lee et al.: Dietary patterns and self-reported association of diet with symptoms of inflammatory bowel disease. 2013, Digestive Diseases and Sciences, 58:1322-1328, https://doi.org/10.1007/s10620-012-2373-3
-
-
-
C Walton et al: Enteral feeding reduces metabolic activity of the intestinal microbiome in Crohn’s disease: an observational study. 2016, European Journal of Clinical Nutrition, 70:1052-1056, https://doi.org/10.1038/ejcn.2016.74
-
-
-
S R Llewellin, G J Britton et al: Interaction between diet and the intestinal microbiota alter intestinal permeability and colitis severity in mice. 2018, Gastroenterology, 154:1037-1046e.2, https://doi.org/10.1053/j.gastro.2017.11.030
-
-
-
G T Macfarlane, G R Gibson et al: Estimation of short-chain fatty acid production from protein by human intestinal bacteria based on branched-chain fatty acid measurements 1992, FEMS Microbiology Letters, 101:81-86, https://doi.org/10.1111/j.1574-6968.1992.tb05764.x
-
-
-
K Kostovcikova, S Coufal et al: Diet rich in animal protein promotes pro-inflammatory macrophage response and exacerbates colitis in mice. 2019, Frontiers in Immunology, 10:919, https://doi.org/10.3389/fimmu.2019.00919
-
-
-
K J Portune, M Beaumont et al: Gut microbiota role in dietary protein metabolism and health-related outcomes: the two sites of coin. 2016, Trends in Food Science and Technology, 57B:213-232, https://doi.org/10.1016/j.tifs.2016.08.011
-
-
-
G R Gibbson, J H Cummings, G T Macfarlain: Growth and activities of sulfate-reducing bacteria in gut contents of healthy subjects and patients with ulcerative colitis. 1991, Trends in Food Science and Technology, 86:103-111, https://doi.org/10.1111/j.1574-6968.1991.tb04799.x
-
-
-
B Lamas, M L Richard et al: CARD9 impacts colitis by altering gut microbiota metabolism of tryptophan into aryl hydrocarbon receptor ligands. 2016, Nature Medicine, 22:598-605, https://doi.org/10.1038/nm.4102
-
-
-
J Islam, S Sato et al: Dietary tryptophan alleviates dextran sodium sulfate-induced colitis through aryl hydrocarbon receptor in mice. 2017, Journal of Nutritional Biochemistry, 42:43-50, https://doi.org/10.1016/j.jnutbio.2016.12.019
-
-
-
I Kepert, J Fonseca et al: D-tryptophan from probiotic bacteria influences the gut microbiome and allergic airway disease. 2017, Journal of Allergy and Clinical Immunology, 139-1525-1535, https://doi.org/10.1016/j.jaci.2016.09.003
-
-
-
S Devkota, Y Wang et al: Dietary-fat-induced taurocholic acid promotes pathobiont expansion and colitis in II 10-/- 2012, Nature, 487:104-108, https://doi.org/10.1038/nature11225
-
-
-
M Watanabe, S Fukiya, A Yokota: Comprehensive evaluation of the bactericidal activities of free bile acids in the large intestine of humans and rodents. 2017, Journal of Lipid Research, 58:1143-1152, https://doi.org/10.1194.jlr.M075143
-
-
-
A Casadevall: The pathogenic potential of a microbe. 2017, mSphere, 2:e00015-17, https://doi.org/10.1128/mSphere.00015-17
-
-
-
H D Holscher, H M Guetterman et al: Walnut consumption alters gastrointestinal microbiota, microbially derived secondary bile acids, and health markers in healthy adults: a randomized, controlled trial. 2018, Journal of Nutrition, 148:861-867, https://doi.org/10.1093/jn/nxy004
-
-
-
K A Kim, W Gu et al.: High fat diet-induced gut microbiota exacerbates inflammation and obesity in mice via the TLR4-signalling pathway. 2012, PLOS ONE, 7:e47713, https://doi.org/10.1371/journal.pone.0047713
-
-
-
C D Cani, C Knauf et al: Improvement of glucose tolerance and hepatic insulin sensitivity by oligofructose requires a functional glucagon-like peptide 1 receptor. 2006, Diabetes, 55:1484-1490, https://doi.org/10.2337/db05-1360
-
-
-
R N Carmody, J E Bisanz et al: Cooking shapes the structure and function of the microbiome. 2019, Nature Microbiology, 4:2052-2063, https://doi.org/10.1038/s41564-019-0569-4
-
-
-
N Koppel, V Rekdal, E P Balskus: Chemical transformation of xenobiotics by the human gut microbiota. 2017, Science, 356:eaag2770, https://doi.org/10.1126/science.aag2770
-
-
-
J A Arcila, D J Rose: Repeated cooking and freezing of whole wheat flour increases resistant starch with beneficial impacts on in vitro fecal fermentation properties. 2015, Journal of Functional Foods, 12:230-236, https://doi.org/10.1016/j.jff.2014.11.023
-
-
-
A Lerner, T Matthias: Changes in intestinal tight junction permeability associated with industrial food additives explain the rising incidence of autoimmune disease. 2015, Autoimmunity Reviews, 14:479-489, https://doi.org/10.1016/j.autrev.2015.01.009
-
-
-
K Makki, E C Dehan et al: The impact of dietary fiber on gut microbiota in host health and disease. 2018, Cell Host & Microbe, 23:705-715, https://doi.org/10.1016/j.chom.2018.05.012
-
-
-
A Swidsinski, Y Dörffel et al: Reduced mass and diversity of the colonic microbiome in patients with multiple sclerosis and their improvement with ketogenic diet. 2017, Frontiers in Microbiology, 8:1141, https://doi.org/10.3389/fmicb.2017.01141
-
-
-
A Volkova, K V Ruggles: Predictive metagenomics analysis of autoimmune disease identifies robust autoimmunity and disease specific microbial signatures. 2021, Frontiers in Microbiology, 12:621310, https://doi.org/10,3389/fmicb.2021.621310
-
-
-
A J Johnson, P Vangay et al: Daily sampling reveals personalized diet-microbiome associations in human. 2019, Cell Host & Microbe, 25:789-802.e5, https://doi.org/10.1016/j.chom.2019.05.005
-
-
-
B Mahesh: Machine learning algorithms – A Review. 2018, International Journal of Science and Research, 9:381-386, https://doi.org/10.21275/ART20203995
-
-
-
D Zeevi, T Korem et al: Personalized nutrition by prediction of glycemic responses. 2015, Cell, 163:079-1094, https://doi.org/10.1016/j.cell.2015.11.001
-
-
-
N Zmore, G Zilberman-Schapira et al: Personalized gut mucosal colonization resistance to empiric probiotics is associated with unique host and microbiome features. 2018, Cell, 174:1388-1405.e21, https://doi.org/10.1016/j.cell.2018.08.041
-
-
-
T Korem, D Zeevi et al: Bread affects clinical parameters and induces gut microbiome-assisted personal glycemic responses. 2017, Cell Metabolism, 25:1243-1253.e5, https://doi.org/10.1016/j.cmet.2017.05.002
-
-
-
R Valcheva, P Koleva et al: Inulin-type fructans improve active ulcerative colitis associated with microbiota changes and increased short-chain fatty acid levels. 2019, Gut Microbes, 10:334-357, https://doi.org/10.1080/19490976.2018.1526583
-
-
-
M N Quraishi, M Widlak et al: Systematic review with meta-analysis: the efficacy of fecal microbiota transplantation for the treatment of recurrent and refractory Clostridium difficile infection. 2017, Alimentary Pharmacology & Therapeutics, 46:479-493, https://doi.org/10.1111/apt.14201
-
-
-
P de Groot, T Nikolic et al: Fecal Microbiota transplantation halts progression of human new onset type 1 diabetes in a randomized controlled trial. 2021, Gut, 70:92-105, https://doi.org/10.1136/gutjnl-2020-322630
-
-
-
P A Engen, A Zaferiou et al: Single-arm non-randomized time series, single subject study of fecal microbiota transplantation in multiple sclerosis. 2020, Frontiers in Neurology, 11:978, https://doi.org/10.3389/fneur.2020.00978
-
-
-
Y H van Beurden, T van Gils et al.: Serendipity in refractory celiac disease: full recovery of duodenal villi and clinical symptoms after fecal microbiota transfer. 2016, Journal of Gastrointestinal and Liver Diseases, 25:385-388, https://doi.org/10.15403/jgld.2014.1121.253.cel
-
-
-
J Zeng, L Peng et al: Fecal microbiota transplantation for rheumatoid arthritis: a caser report. 2021, Clinical Case Reports, 9:906-909, https://doi.org/10.1002/ccr3.3677
-
-
-
S P Costello, P A Hughes et al: Effect of fecal microbiota transplantation of 8-week remission in patients with ulcerative colitis: a randomized clinical trial. 2019, JAMA, 321:156-164, https://doi.org/10.1001/jama.2018.20046
-
-
-
P Moayyedi, M G Surette et al. Fecal microbiota transplantation induces remission in patients with active ulcerative colitis in a randomized controlled trial. 2015, Gastroenterology, 149:102-109.e6, https://doi.org/10.1053/j.gastro.2015.04.001
-
-
-
S Paramsothy, M A Kamm et al: Multidonor intensive faecal microbiota transplantation for active ulcerative colitis: a randomised placebo-controlled trial. 2017, Lancet, 389:1218-1228, https://doi.org/10.1016/S0140-6736(17)30182-4
-
-
-
N G Rossen, S Fuentes et al: Finding from randomized controlled trial of fecal transplantation for patients with ulcerative colitis. 2015, Gastroenterology, 149:110-118.e4, https://doi.org/10.1053/j.gastro.2015.03.045
-
-
-
V G Vaughn, T Vatanen et al: Increase intestinal microbial diversity following fecal microbiota transplant for active Crohn’s disease. 2016, Inflammatory Bowel Diseases, 22:2182-2190, https://doi.org/MIB.0000000000000893
-
-
-
B Cui, Q Feng et al: Fecal microbiota transplantation through mid-gut for refractory Crohn’s disease: safety, feasibility, and efficacy trial results. 2015, Journal of Gastroenterology and Hepatology, 30:51-58, https://doi.org/10.1111/jgh.12727
-
-
-
C A Philips, A Pande et al: Healthy donor fecal microbiota transplantation in steroid-ineligible severe alcoholic hepatitis: a pilot study. 2017, Clinical Gastroenterology and Hepatology, 5:600-602, https://doi.org/10.1016/j.cgh.2016.10.029
-
-
-
J S Bajaj, Z Kassam et al: Fecal microbiota transplant from a rational stool donor improves hepatic encephalopathy: a randomized clinical trial. 2017, Hepatology, 66:1727-1738, https://doi.org/10.1002/hep.29306
-
-
-
R S Kootle, E Levin et al: Improvement of insulin sensitivity after lean donor feces in metabolic syndrome is driven by baseline intestinal microbiota composition. 2017, Cell Metabolism, 26:611-619.e6, https://doi.org/10.1016/j.cmet.2017.09.008
-
-
-
D V Kang, J B Adams et al: Long-term benefit of microbiota transfer therapy on autism symptoms and gut microbiota. 2019, Science Reports, 9:5821, https://doi.org/10.1038/s41598-019-42183-0
-
-
-
J Lloyd-Price, C Arze et al: Multi-omics of the gut microbial ecosystem in inflammatory bowel diseases. 2019, Nature, 569:655-662, https://doi.org/10.1038/s41586-019-1237-9
-
-
-
F E Dailey, E P Turse et al: The dirty aspects of fecal microbiota transplantation: a review of its adverse effects and complications. 2019, Current Opinion in Pharmacology, 49:29-33, https://doi.org/10.1016/j.coph.2019.04.008
-
-
-
B C Wilson, T Vatanen et al: The super-donor phenomenon in fecal microbiota transplantation. 2019, Frontiers in Cellular and Infection Microbiology, 9:2, https://doi.org/10.3389/fcimb.2019.00002
-
-
-
N C Knox, J D Forbes et al: The gut microbiome as a target for IBD treatment: are there yet? 2019, Current Treatment Options in Gastroenterology, 17:115-126, https://doi.org/10.1007/s11938-019-00221-w
-
-
-
C Burrello, F Garavaglia et al: Therapeutic faecal microbiota transplantation controls intestinal inflammation through IL10 secretion by immune cells. 2018, Nature Communications, 9:5184, https://doi.org/10.1038/s41467-018-07359-8
-
-
-
Y O Yang, S H Lee et al: Fecal microbial transplantation and a high fiber diet attenuates emphysema development by suppressing inflammation and apoptosis. 2020, Experimental & Molecular Medicine, 52:1128-1139, https://doi.org/10.1038/s12276-020-0469-y
-
-
-
A Levine, E Wine et al: Crohn’s disease exclusion diet plus partial enteral nutrition induces sustained remission in a randomized controlled trial. 2019, Gastroenterology, 117:440-450.e8, https://10.1053/j.gastro.2019.04.021
-
-
-
E O Petrof, G B Gloor et al: Stoll substitute transplant therapy for the eradication of Clostridium difficile infection: rePOOPulating the gut. 2013, Microbiome, 1:3, https://doi.org/10.1186/2049-2618-1-3
-
-
-
T Tanoue, S Morita et al: A defined commensal consortium elicits CD8 T cells and anti-cancer immunity. 2019, Nature, 65:600-605, https://doi.org/10.1038/s41586-019-0878-z
-
-
-
A Sood, V Midha et al: The prebiotic preparation VSL#3 induces remission in patients with mid-to-moderately active ulcerative colitis. 2009, Clinical Gastroenterology and Hepatology, 7:1202-1209, https://doi.org/10.1016/j.cgh.2009.07.016
-
-
-
Y Derwa, D J Gracie et al: Systematic review with meta-analysis: the efficacy of probiotics in inflammatory bowel disease. 2017, Alimentary Pharmacology & Therapeutics, 46:389-400, https://doi.org/10.1111/apt.14203
-
-
-
M Ganji-Arjenaki, M Rafieian-Kopaei: Probiotics are good choice in remission of inflammatory bowel diseases: a meta-analysis and systemic review. 2018, Journal of Cellular Physiology, 233:2091-2103, https://doi.org/10.1002/jcp.25911
-
-
-
C P Champagne, N J Gardner, D Roy: Challenges in the addition of probiotic culture to food. 2005, Critical Reviews in Food Science and Nutrition, 45:61-84, https://doi.org/10.1080/10408690590900144
-
-
-
A Lerner, T Matthias, R Aminov: Potential effects of horizontal gene exchange in the human gut. 2017, Frontiers in Immunology, 8:1630, https://doi.org/10.3389/fimmu.2017.01630
-
-
-
S Fujimori, K Gudis et al: A randomized controlled trial on the efficacy of synbiotic versus probiotic or prebiotic treatment to improve the quality of life in patients with ulcerative colitis. 2009, Nutrition, 25:520-525, https://doi.org/10.1016/j.nut.2008.11.017
-
-
-
T Amiriani, N Rajabli et al: Effect of LactocareÒ synbiotic on disease severity in ulcerative colitis: a randomized, placebo-controlled double blind clinical trial. 2020, Synbiotic and Disease Severity in Ulcerative Colitis, 12:27-33, https://doi.org/10.15171/mejdd.2020.160
-
-
-
E Furrie, S Macfarlane et al: Synbiotic therapy (Bifidobacterium longum/Synergy 1) initiates resolution of inflammation in patients with active ulcerative colitis: a randomized controlled pilot trial. 2005, Gut, 54:242-249, https://doi.org/10.1136/gut.2004.044834
-
-
-
H Steed, G T Macfarlane et al: Clinical trial: microbiological and immunological effect of synbiotic consumption – a randomized double-blind placebo-controlled study in active Crohn’s disease. 2010, Alimentary Pharmacology and Therapeutics, 32:872-883, https://doi.org/10.1111/j.1365-2036.2010.04417.x
-
-
-
B Zamani, S Farshbach et al: Synbiotic supplementation and the effects on clinical and metabolic responses in patents with rheumatoid arthritis: a randomized, double-blind, placebo-controlled trial. 2017, British Journal of Nutrition, 117:1095-1102, https://doi.org/10.1017/S000711451700085X
-
-
-
A Z Javid, M Amizadeh et al: The effect of synbiotic supplementation on glycemic status, lipid profile, and biomarker of oxidative stress in type 1 diabetic patients. A placebo-controlled double-blind, randomized clinical trial. 2020, Diabetes, Metabolic Syndrome and Obesity, 13:607-617, https://doi.org/10.2147/DMSO.S238867
-
-
-
S M Kearney, S M Gibbons et al: Orthogonal dietary niche enables reversible engraftment of a gut bacterial commensal. 2018, Cell Reports, 24:1842-1851, https://doi.org/10.1016/j.celrep.2018.07.032
-
-
-
E S Shepherd, W C Deloache et al: An exclusive metabolic niche enables strain engraftment in the gut microbiota. 2018, Nature, 557:434-438, https://doi.org/10.1038/s41586-018-0092-4
-
-
-
A Pocheville: The ecological niche: history and recent controversies. 2015, in: T Heams et al (editors): Handbook of Evolutionary Thinking in the Science, https://d1wqtxts1xzle7.cloudfront.net/50450800/ecological-niche-history-161121-with-cover-page-v2.pdf?Expires=1669392438&Signature=E9eMQGmGN1R7sC2Ktkhobx8Nsj2~XeFlKU0ePKPEUNvdvJJ4QEhrPSkOmx6nw6-OkqMxZ-v5lj4~tJCDzV9Abjoegq7t8A63~7wuUUrHEC0Yu9YsZ7M-rrQ~DO5oR1d7GKKqB7q1-w3WurP4KE6E4B7x3f~L~5c5U3fBy8i5-UpRCJESkFieusaz-hhnGsQD0RSgqHsIZBRIAv~qmonIyy9E-alAuJKu4YOhK9V8bvmRl5I-OytyZQFGliKBoH-hzeRnrOsDoBeNIdyleGsLIPq7OyxcRrumbATVkQAU4ItvT6Jw7MFF~7a-PeAIurVTnuzi0ANQ1~1xPrNRqeTkJg__&Key-Pair-Id=APKAJLOHF5GGSLRBV4ZA
-
-
-
N A Pudlo, G V Preira et al: Extensive transfer of genes for edible seaweed digestion from marine to human gut bacteria. 2020, bioRxiv, https://doi.org/10.1101/2020.06.09.142968
-
-
-
Q Mu, H Zhang et al: Control of lupus nephritis by changes of gut microbiota. 2017, Microbiome, 5:73, https://doi.org/10.1186/s40168-017-0300-8
-
-
-
B He, T K Hoang et al: Lactobacillus reiteri reduces the severity of experimental autoimmune encephalitis in mice by modulating microbiota. 2019, Frontiers in Immunology, 10:385, https://doi.org/10.3389/fimmu.2019.00385
-
-
-
A de Moreno de LeBlanc, S del Carmen et al: Evaluation of the biosafety of recombinant lactic acid bacteria designed to prevent and treat colitis. 2016, Journal of Medical Microbiology, 65:1038-1046, https://doi.org/10.1099/jmm.0.000323
-
-
-
L Zeng, J Tan et al: An engineering probiotic producing defensin-5 ameliorating dextran sodium sulfate-induced mice colitis via inhibiting NF-kB pathway. 2020, Journal of Translational Medicine, 18:107, https://doi.org/10.1186/s12967-020-02272-5
-
-
-
J U Scher, A Sczesnak et al: Expansion of intestinal Prevotella copri correlates with enhanced susceptibility to arthritis. 2013, eLife, e1202, https://doi.org/10.7554/eLife.01202
-
-
-
J Kjeldsen-Kragh, M Haugen et al: Controlled trial of fasting and one-year vegetarian diet in rheumatoid arthritis. 1991, Lancet, 338:899-902, https://doi.org/10.1016/0140-6736(91)91770-u
-
-
-
M Stoll: Genetics, Prevotella, and the pathogenesis of rheumatoid arthritis. 2020, Lancet Rheumatology, 2:e375-e376, https://doi.org/10.1016/S2665-9913(20)30090-4
-
-
-
R Peltonen, M Nenonen et al: Faecal microbial flora and disease activity in rheumatoid arthritis during a vegan diet. 1997, British Journal of Rheumatology, 36:64-68, https://doi.org/10.1093/rheumatology/36.1.64
-
-
-
H Schellekens, C Torres-Fuentes et al: Bifidobacterium longum counters the effect of obesity: Partially successful translation from rodent to human. 2021, eBiomedicine, 63:103176, https://doi.org/10.1016/j.ebiom.2020.10317
-
-
-
G K Fragiadakis, H C Wastyk et al: Long-term dietary intervention reveals resilience of the gut microbiota despite changes in diet and weight. 2020, American Journal of Clinical Nutrition, 111:1127-1136, https://doi.org/10.1093/ajcn/nqaa046
-


